
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
【答案】6 ![]() C
C ![]() C 8∶9 Be+2OH-+2H2O===[Be(OH)4]2-+H2↑ NaOH溶液
C 8∶9 Be+2OH-+2H2O===[Be(OH)4]2-+H2↑ NaOH溶液
【解析】
(1)具有一定质子数和中子数的原子是核素;
(2)质子数相同,中子数不同的同种元素的不同原子互为同位素,质量数=质子数+中子数;
(3)H2O与D2O的摩尔质量分别为18g/mol、20g/mol,二者分子中分别含有中子数为8、10;
(4)元素周期表中,处于对角线位置的元素具有相似的性质,则根据铝的单质的性质可推断铍与氢氧化钠的反应;
(5)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应。
(1)具有一定质子数和中子数的原子是核素,![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,均为核素,所以一共有6种核素,168O2、168O3为单质;
,均为核素,所以一共有6种核素,168O2、168O3为单质;
(2)![]() 、146C质子数相同而中子数不同的同一元素的不同原子互称同位素;
、146C质子数相同而中子数不同的同一元素的不同原子互称同位素;
(3)质量相同的H2O与D2O的物质的量与摩尔质量成反比,二者物质的量之比=20g/mol:18g/mol=10:9,所含的中子数之比=(10×8):(9×10)=8:9;
(4)金属铍与铝的单质及其化合物性质相似,则Be与NaOH溶液反应生Na2[Be(OH)4]和氢气,离子反应为:Be+2OH-+2H2O=[Be(OH)4]2-+H2↑;
(5)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应,则选NaOH溶液鉴别,离子反应为Be(OH)2+2OH-=BeO22-+2H2O。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______(填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
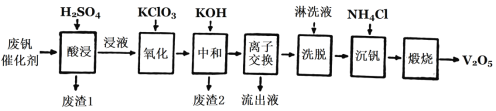
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________,同时V2O5转化为VO2+。“废渣1”的主要成分是________。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____。
(6)“煅烧”中发生反应的化学方程式2NH4VO3![]() V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__kg(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
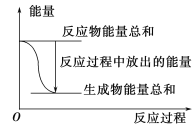
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:

已知硝酸能将Fe2+氧化为Fe3+。回答下列问题:
(1) A可能是________________;
(2) B的化学式是______________,D的化学式是____________;
(3)滤液C中一定含有的阳离子Fe3+是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如下表。

请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________。
(2)实验仪器:①________;②________;③________;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):
①________;②________;③________;④________;⑤________;⑥________。
(5)写出实验操作②、⑥中有关反应的离子方程式:
实验②________________________,实验⑥______________________。
(6)实验结论:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ___________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2![]() 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) ![]() CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-![]() 2As+3
2As+3![]() +6M关于该反应的说法中正确的组合是
+6M关于该反应的说法中正确的组合是
①氧化剂是H3AsO3
②还原性:As>SnCl2
③每生成1molAs,反应中转移电子的物质的量为3mol
④M为OH-
⑤![]() 是氧化产物
是氧化产物
A.①②④⑤B.①③⑤C.①②③④D.只有①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com