
【题目】生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______(填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
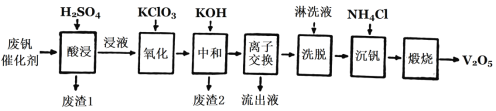
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________,同时V2O5转化为VO2+。“废渣1”的主要成分是________。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____。
(6)“煅烧”中发生反应的化学方程式2NH4VO3![]() V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__kg(保留小数点后一位)。
【答案】BC V2O4+4H+=2VO2++2H2O SiO2 1:6 碱 用铂丝蘸取“流出液”在无色火焰上灼烧,隔着蓝色钴玻璃观察,火焰呈紫色,则证明含钾离子 4NH4++V4O124- =4NH4VO3↓ 5.2
【解析】
I.(1)根据反应过程中能量变化分析;
II. 从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。Fe2O3、Al2O3均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此解答该题。
R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此解答该题。
(1) A. 电解食盐水制烧碱是电能转化为化学能,不涉及热交换器的使用,A不符合题意;
B. N2与H2合成NH3的反应是放热反应,可利用热交换器使反应放出的热量给需要反应的N2、H2先进行预热,达到能量的充分利用及节能减排的效果,B符合题意;
C. 硫酸生产中SO2氧化产生SO3的反应是放热反应,可利用热交换器使反应放出的热量给需要反应的SO2、O2先进行预热,使反应混合物温度升高,达到能量的充分利用及节能减排的效果,C符合题意;
D. 煅烧石灰石制取生石灰的反应是吸热反应,不需要使用热交换器,D不符合题意;
故合理选项是BC;
II.(2) “酸浸”时V2O4转化为VO2+,根据电荷守恒、原子守恒,可得该反应的离子方程式为V2O4+4H+=2VO2++2H2O;“废渣1”的主要成分是SiO2;
(3)加氧化剂KClO3,可以将VO2+变为VO2+,KClO3被还原产生KCl,Cl元素化合价由反应前KClO3中的+5价变为反应后KCl中的-1价,降低6价,V元素化合价由反应前VO2+中是+4价变为反应后VO2+中的+5价,升高1价,根据氧化还原反应中元素化合价升降总数相等,可知化合价升降最小公倍数是6,所以KClO3与VO2+反应的物质的量的比是1:6,即“氧化”环节中氧化剂KClO3与还原剂VO2+的物质的量之比为1:6;
(4)根据平衡移动原理,要提高化洗脱效率,应该使化学平衡逆向移动,应该增大溶液中c(OH-),即淋洗液应该呈碱性;
(5)根据流程图可知“流出液”中主要为硫酸钾,含量最多的阳离子是K+,检验K+存在的方法是利用焰色反应,实验操作步骤是用铂丝蘸取“流出液”在无色火焰上灼烧,隔着蓝色钴玻璃观察,火焰呈紫色,则证明含K+;
(6)“煅烧”中发生反应的化学方程式是2NH4VO3![]() V2O5+H2O+2NH3↑,则“沉钒”过程中加热NH4Cl会与溶液中的V4O124-反应形成NH4VO3,该反应的离子方程式为:4NH4++V4O124- =4NH4VO3↓;
V2O5+H2O+2NH3↑,则“沉钒”过程中加热NH4Cl会与溶液中的V4O124-反应形成NH4VO3,该反应的离子方程式为:4NH4++V4O124- =4NH4VO3↓;
(7)若有100 kg该废钒催化剂,由于其中V2O5的含量为2.20~2.90%,V2O4的含量为2.8~3.32%,若转化中钒元素利用率为80%,则最多可回收到V2O5的质量为m(V2O5)=(100 kg×2.90%+100 kg×3.32%×![]() )×80%=5.2 kg。
)×80%=5.2 kg。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】PT(KHC2O4·H2C2O4·2H2O,名称:四草酸钾)是一种分析试剂。室温时,H2C2O4的pKa1、pKa2分别为1.23、4.19(pKa=-lgKa)。下列说法不正确的是( )
A.0.1mol·L-1PT溶液中:c(HC2O![]() )>c(K+)>c(H2C2O4)
)>c(K+)>c(H2C2O4)
B.0.1mol·L-1PT中滴加NaOH至溶液pH=4.19:c(C2O![]() )=c(HC2O
)=c(HC2O![]() )
)
C.0.1mol·L-1PT中滴加NaOH至溶液呈中性:c(K+)>c(Na+)>c(HC2O![]() )>c(C2O
)>c(C2O![]() )
)
D.0.1mol·L-1PT与0.1mol·L-1KOH溶液等体积混合,溶液中水的电离程度比纯水的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知把ag金属铜投入一定量浓硝酸中,反应开始产生红棕色气体,随着反应的进行,产生的气体颜色逐渐变浅,最后变为无色,反应过程中共收集到标准状况下气体VL,剩余固体bg。
(1)写出反应过程中发生的化学反应___、___。
(2)在产生无色气体的反应中___是还原剂;被还原的HNO3与参加反应的HNO3的质量之比为___;当有1molHNO3参加反应时,该反应转移的电子的物质的量为___。
(3)在上面反应过程中,参加反应的HNO3的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟硼铍酸钾(KBeBF,含K、B、Be、O、F元素)。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出___种波长不同的光。
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是__。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是___。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF![]() 使酸性大大增强。HF
使酸性大大增强。HF![]() 的结构式为___;H3BO3和BF
的结构式为___;H3BO3和BF![]() 中,B原子的杂化类型分别为___、__。
中,B原子的杂化类型分别为___、__。
(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为____。

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是___。

②BeO晶胞中,O的堆积方式为____;设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
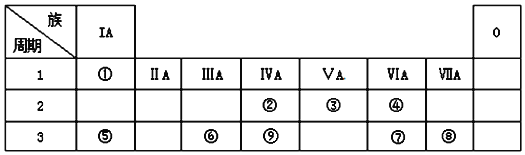
(1)第三周期中元素非金属性最强的元素的原子结构示意图为____________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)___________。
(3)用电子式表示④的简单氢化物的形成过程______________。
(4)下列可以判断⑤和⑥金属性强弱的是_________
a.⑤单质的熔点比⑥单质低
b.⑤的化合价比⑥低
c.⑤单质与水反应比单质⑥剧烈
d.⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
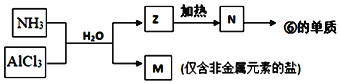
a.M中所含的化学键种类为(若含共价键,请标明极性或非极性)___________。
b.N→⑥的单质的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的

A. 增大X或Y的浓度 B. 增大压强
C. 增大Z的浓度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
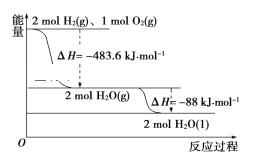
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com