
【题目】已知把ag金属铜投入一定量浓硝酸中,反应开始产生红棕色气体,随着反应的进行,产生的气体颜色逐渐变浅,最后变为无色,反应过程中共收集到标准状况下气体VL,剩余固体bg。
(1)写出反应过程中发生的化学反应___、___。
(2)在产生无色气体的反应中___是还原剂;被还原的HNO3与参加反应的HNO3的质量之比为___;当有1molHNO3参加反应时,该反应转移的电子的物质的量为___。
(3)在上面反应过程中,参加反应的HNO3的物质的量为___。
【答案】Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O Cu 1∶4 0.75mol (![]() +
+![]() )mol
)mol
【解析】
(1)硝酸的浓度不同,反应生成的产物不同,浓度较高生成二氧化氮,较低生成气体一氧化氮;
(2)硝酸被还原成含氮气体,未被还原的硝酸最后生成了Cu(NO3)2 ,写出反应方程式分析解答;
(3)反应前后氮原子守恒的,而反应后氮原子存在于硝酸铜和含氮气体当中,由此列出等式计算得出答案。
(1)浓硝酸氧化能力强,最后生成NO2,稀硝酸氧化性弱,最后生成NO ,所以反应开始是Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O,随着反应进行,硝酸浓度降低,发生反应3Cu+ 8HNO3(稀)= 3Cu(NO3)2+ 2NO↑+4H2O;
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)产生无色气体,则是铜与稀硝酸的反应3Cu+ 8HNO3(稀)=3Cu(NO3)2+ 2NO↑+4H2O,其中Cu是还原剂,未被还原的HNO3最后形成Cu(NO3)2 ,从反应方程式中可以看出,被还原的HNO3(2mol)与参加反应的HNO3(8mol)的质量之比为1:4;1mol硝酸参加反应,则有![]() molCu参与反应,转移电子
molCu参与反应,转移电子![]() × 2mol=0.75mol;
× 2mol=0.75mol;
故答案为:Cu;1∶4;0.75mol;
(3 )根据氮原子反应前后守恒,则n总=2n硝酸铜+n气体= 2n铜+ n气体,由此可得参与反应的硝酸的物质的量是(![]() )mol=(
)mol=(![]() )mol,
)mol,
故答案为:(![]() )mol。
)mol。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH![]() 的数目为NA
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molNaHSO4固体中含有离子总数为3NA
B.11.2L(标准状况)HF含有质子数为5NA
C.50g46%的乙醇水溶液中,含有O—H键数为3.5NA
D.1molCu与足量的硫蒸气反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化如图所示,则下列说法中正确的是
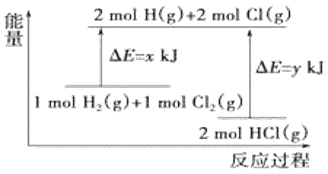
A.该反应是吸热反应
B.断裂1molH-H键和1molCl-Cl键时能放出x kJ的能量
C.断裂2molH-Cl键时需要吸收y kJ的能量
D.2molHCl(g)的总能量高于1molH2(g)和1molCl2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。
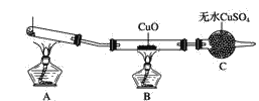
(1)利用该装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。则氨气与CuO反应的化学方程式为___。
(2)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+→Cu+Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O。____。
(3)该装置在设计上存在明显缺陷,为保证实验结果的准确性,需在A和B之间增加一个装置D,为什么?___。
请画出装置D的示意图并表明所需试剂_____、_____。(限选仪器和药品:浓H2SO4、碱石灰、集气瓶、干燥管、玻璃导管、单孔赛、双孔塞)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______(填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
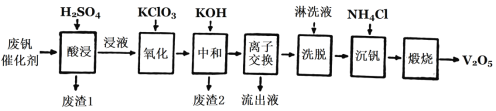
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________,同时V2O5转化为VO2+。“废渣1”的主要成分是________。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____。
(6)“煅烧”中发生反应的化学方程式2NH4VO3![]() V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__kg(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
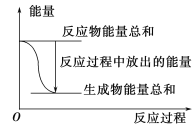
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com