
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molNaHSO4固体中含有离子总数为3NA
B.11.2L(标准状况)HF含有质子数为5NA
C.50g46%的乙醇水溶液中,含有O—H键数为3.5NA
D.1molCu与足量的硫蒸气反应,转移电子数为2NA
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
A. 2 mol NH3B. 1 mol N2、3 mol H2和2 mol NH3
C. 0.5 mol N2、1.5 mol H2和1 mol NH3D. 0.1 mol N2、0.3 mol H2和1.8 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多年来,储氢材料、光催化剂与硼酸盐材料的研究一直是材料领域的热点研究方向。回答下列问题:
一种Ru络合物与g-C3N4符合光催化剂将CO2还原为HCOOH的原理如图。
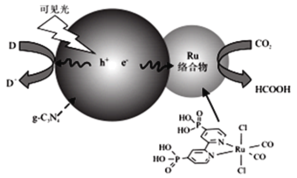
(1)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___,Ru络合物含有的片段![]() 和
和![]() 中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
(2)基态碳原子的价电子排布图为___,HCOOH的沸点比CO2高的原因是___。
(3)2019年8月13日中国科学家合成了白光材料Ba2[Sn(OH)6][B(OH)4]2,[B(OH)4]-中B的价层电子对数为____,[Sn(OH)6]2-中,Sn与O之间的化学键不可能是___。
a.π键 b.σ键 c.配位键 d.极性键
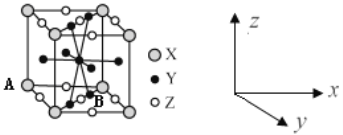
(4)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为___(填化学式)。若原子分数坐标A为(0,0,0),则B(Y)的原子分数坐标为___,已知LaNi5H6摩尔质量为499g·mol-1,晶体密度为g·cm-3,设NA为阿伏加德罗常数的值,则晶胞参数为a=___pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水利用的部分过程。下列有关说法正确的是

A. 由反应①可知:相同温度下,NaHCO3 的溶解度大于 Na2CO3
B. 反应②的离子方 程式为:Br2+SO2+2H2O=SO42-+2Br-+4H+
C. 可通过电解 MgCl2 溶液制得金属镁
D. 粗盐中含有的 Mg2+、SO4 2-等杂质离子,可通过依次加入 BaCl2溶液、NaOH 溶液、盐酸等试剂加以去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知把ag金属铜投入一定量浓硝酸中,反应开始产生红棕色气体,随着反应的进行,产生的气体颜色逐渐变浅,最后变为无色,反应过程中共收集到标准状况下气体VL,剩余固体bg。
(1)写出反应过程中发生的化学反应___、___。
(2)在产生无色气体的反应中___是还原剂;被还原的HNO3与参加反应的HNO3的质量之比为___;当有1molHNO3参加反应时,该反应转移的电子的物质的量为___。
(3)在上面反应过程中,参加反应的HNO3的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
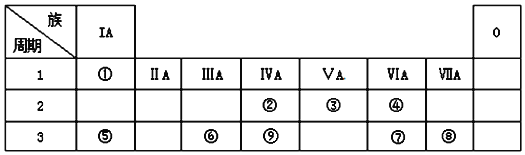
(1)第三周期中元素非金属性最强的元素的原子结构示意图为____________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)___________。
(3)用电子式表示④的简单氢化物的形成过程______________。
(4)下列可以判断⑤和⑥金属性强弱的是_________
a.⑤单质的熔点比⑥单质低
b.⑤的化合价比⑥低
c.⑤单质与水反应比单质⑥剧烈
d.⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
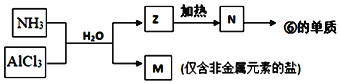
a.M中所含的化学键种类为(若含共价键,请标明极性或非极性)___________。
b.N→⑥的单质的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com