
【题目】多年来,储氢材料、光催化剂与硼酸盐材料的研究一直是材料领域的热点研究方向。回答下列问题:
一种Ru络合物与g-C3N4符合光催化剂将CO2还原为HCOOH的原理如图。
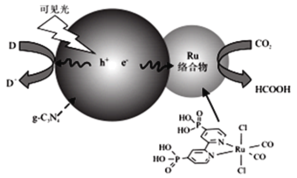
(1)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___,Ru络合物含有的片段![]() 和
和![]() 中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
(2)基态碳原子的价电子排布图为___,HCOOH的沸点比CO2高的原因是___。
(3)2019年8月13日中国科学家合成了白光材料Ba2[Sn(OH)6][B(OH)4]2,[B(OH)4]-中B的价层电子对数为____,[Sn(OH)6]2-中,Sn与O之间的化学键不可能是___。
a.π键 b.σ键 c.配位键 d.极性键
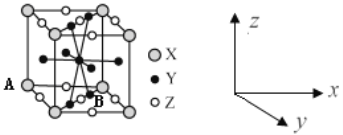
(4)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为___(填化学式)。若原子分数坐标A为(0,0,0),则B(Y)的原子分数坐标为___,已知LaNi5H6摩尔质量为499g·mol-1,晶体密度为g·cm-3,设NA为阿伏加德罗常数的值,则晶胞参数为a=___pm(用代数式表示)。
【答案】N>O>C sp2 ![]()
![]() HCOOH和CO2都为分子晶体,HCOOH分子间形成氢键 4 a H2 (
HCOOH和CO2都为分子晶体,HCOOH分子间形成氢键 4 a H2 (![]() ,
,![]() ,0)
,0) 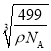 ×1010
×1010
【解析】
根据元素第一电离能的变化趋势比较元素的第一电离能的大小关系,根据杂化轨道理论和大π键的成键特点判断氮原子的轨道杂化方式,根据配位键的成键条件判断![]() 和
和![]() 中谁的氮原子配位能力更强。根据价层电子对互斥理论分析中心原子的价层电子对数,根据Sn与O的成键特点判断其所形成的化学键类型。根据均摊法确定晶胞中各种微粒的个数,再结合晶体的化学式确定微粒Z的类型,根据晶胞结构及其粒子的空间分布特点判断其坐标参数,根据晶胞的密度和质量计算晶胞的边长。
中谁的氮原子配位能力更强。根据价层电子对互斥理论分析中心原子的价层电子对数,根据Sn与O的成键特点判断其所形成的化学键类型。根据均摊法确定晶胞中各种微粒的个数,再结合晶体的化学式确定微粒Z的类型,根据晶胞结构及其粒子的空间分布特点判断其坐标参数,根据晶胞的密度和质量计算晶胞的边长。
(1)同周期从左向右元素的第一电离能总体呈增大趋势,但是第ⅤA族元素比同周期的第ⅥA族元素的第一电离能大,故N、O、C的第一电离能依次减小;![]() 和
和![]() 中都存在大π键,氮原子均采用sp2杂化,
中都存在大π键,氮原子均采用sp2杂化,![]() 的大π键为π66,N原子有一对孤电子对,
的大π键为π66,N原子有一对孤电子对,![]() 的大π键为π56,N原子无孤电子对,因此氮原子配位能力更强的是
的大π键为π56,N原子无孤电子对,因此氮原子配位能力更强的是![]() ,故答案为:N>O>C;sp2;
,故答案为:N>O>C;sp2;![]() ;
;
(2)碳原子为6号元素,根据构造原理可写出基态碳原子的电子排布式为1s22s22p2,故基态碳原子的价电子排布图为![]() ;HCOOH和CO2都为分子晶体,但是HCOOH分子间可形成氢键,故HCOOH的沸点比CO2高;
;HCOOH和CO2都为分子晶体,但是HCOOH分子间可形成氢键,故HCOOH的沸点比CO2高;
(3)[B(OH)4]-中硼原子连接四个羟基,其价层电子对数为4;[Sn(OH)6]2-的中心离子Sn4+与OH-之间形成配位键,配位键是一种特殊的共价键,则Sn与O之间形成的化学键属于σ键或极性键,不可能是π键,故答案为:4;a;
(4)根据均摊法可知,晶胞中,微粒X的个数为![]() ,微粒Y的个数为
,微粒Y的个数为![]() ,微粒Z的个数为
,微粒Z的个数为![]() ,根据储氢后所得晶体的化学式LaNi5H6,可知微粒Z为H2;根据晶胞结构图可知,B(Y)的原子分数坐标为(
,根据储氢后所得晶体的化学式LaNi5H6,可知微粒Z为H2;根据晶胞结构图可知,B(Y)的原子分数坐标为(![]() ,
,![]() ,0);晶胞边长
,0);晶胞边长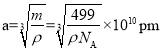 ,故答案为:H2;(
,故答案为:H2;(![]() ,
,![]() ,0);
,0);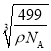 ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】针对下表中的9种元素,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(1)写出⑧的原子结构示意图:_________________________。
(2)形成物质种类最多的元素是__________________。
(3)用电子式表示⑤和⑨形成化合物的过程__________________。
(4)⑤⑥⑦最高正价氧化物对应水化物碱性由强至弱的顺序是_____________。
(5)④的单质与甲醇(CH3OH)形成的碱性燃料电池的负极方程式:________________。
(6)写出⑦的单质与三氧化二铁反应的化学方程式____________________。
(7)③和④的气态氢化物的稳定性顺序为:______________。④和⑧的气态氢化物的沸点顺序为:_____________,出现这种变化的原因是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH![]() 的数目为NA
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下图所示的操作步骤,完成Ba(OH)2·8H2O与氯化铵晶体反应的实验。
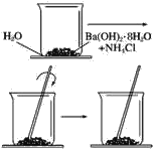
回答下列问题
(1)实验过程中观察到的现象是________________________。
(2)写出该反应的化学方程式___________________。
(3)该反应是放热反应还是吸热反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O![]() 的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
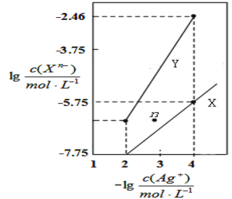
A.Ksp(Ag2C2O4)数量级为10-11
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl-)=c(C2O![]() )的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O
2AgCl(s)+C2O![]() (aq)的平衡常数为10-0.71
(aq)的平衡常数为10-0.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈Ce(OH)4是一种重要的稀土氢氧化物,它可由氟碳酸铈矿(主要含CeFCO3)经如下流程获得:
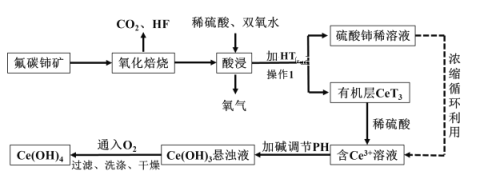
已知:在酸性溶液中![]() 有强氧化性,回答下列问题:
有强氧化性,回答下列问题:
(1)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(2)氧化焙烧生成的铈化合物二氧化铈(CeO2),其在酸浸时反应的离子方程式为___________;
(3)已知有机物HT能将![]() 从水溶液中萃取出来,该过程可表示为:
从水溶液中萃取出来,该过程可表示为:![]() (水层)+
(水层)+![]() (有机层)
(有机层)![]()
![]() +
+![]() (水层)从平衡角度解释:向
(水层)从平衡角度解释:向![]() (有机层)加入
(有机层)加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液的原因是________________;
的水溶液的原因是________________;
(4)取某Ce(OH)4产品0.50g,加硫酸溶解后,与23.00mL0.1000mol/L的FeSO4溶液恰好完全反应(铈被还原成Ce3+).(已知:Ce(OH)4的相对分子质量为208)
①FeSO4在该反应中作________剂(填“氧化”或“还原”);
②计算Ce(OH)4产品的纯度____________;
③若用硫酸酸化后改用0.1000mol/L的FeCl2溶液滴定产品从而测定Ce(OH)4产品的纯度,其它操作都正确,则测定的Ce(OH)4产品的纯度____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molNaHSO4固体中含有离子总数为3NA
B.11.2L(标准状况)HF含有质子数为5NA
C.50g46%的乙醇水溶液中,含有O—H键数为3.5NA
D.1molCu与足量的硫蒸气反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
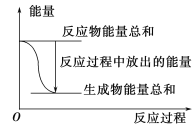
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com