
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
【答案】0.04mol·L-1·s-1 1.5 mol·L-1 0.4 mol·L-1 1∶1 不变 不变 减小 增大 不变
【解析】
3A(g)+B(g)2C(g)+2D(g)
起始(mol): a b 0 0
转化(mol): 1.2 0.4 0.8 0.8
平衡(mol): 1.8 0.6 0.8 0.8
(1) 10s内v(C)=![]() ;
;
(2)反应前,n(A)= 1.8mol+1.2mol=3mol,c(A)=![]() ;
;
(3)10 s末,c(D)=![]() ;
;
(4) 开始时n(A)=(1.8+1.2)mol=3.0mol,开始时n(B)=(0.4+0.6)mol=1.0mol,加入的反应物物质的量之比等于其计量数之比时,反应物的转化率相等;
(5) 反应前后气体计量数之和不变,则反应前后气体总物质的量不变,反应前后气体总质量不变,根据![]() =
=![]() 可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,反应前后气体总质量不变、容器体积不变;
可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,反应前后气体总质量不变、容器体积不变;
(6) ①降低温度,反应速率减小;
②增大A的浓度,反应速率增增大;
③恒容下冲入Ne,对参加反应的气体来说,浓度不变,则速率不变;
3A(g)+B(g)2C(g)+2D(g)
起始(mol): a b 0 0
转化(mol): 1.2 0.4 0.8 0.8
平衡(mol): 1.8 0.6 0.8 0.8
(1)v(C)=![]() =0.04mol·L-1·s-1,
=0.04mol·L-1·s-1,
故答案为:0.04mol·L-1·s-1;
(2)反应前,c(A)=![]() =1.5 mol·L-1,
=1.5 mol·L-1,
故答案为:1.5 mol·L-1;
(3)10 s末,c(D)=![]() =0.4 mol·L-1,
=0.4 mol·L-1,
故答案为:0.4 mol·L-1;
(4) 开始时n(A)=(1.8+1.2)mol=3.0mol,开始时n(B)=(0.4+0.6)mol=1.0mol,加入的反应物物质的量之比等于其计量数之比时,反应物的转化率相等,加入的A.B的物质的量之比等于其计量数之比,则A.B的转化率相等,故α(A)=α(B),则α(A):α(B) =1:1,
故答案为:1:1;
(5) 反应前后气体计量数之和不变,则反应前后气体总物质的量不变,反应前后气体总质量不变,根据![]() =
=![]() 可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量不变;反应前后气体总质量不变、容器体积不变,则密度不变,
可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量不变;反应前后气体总质量不变、容器体积不变,则密度不变,
故答案为:不变;不变;
(6) 由反应3A(g)+B(g)2C(g)+2D(g)可知:
①降低温度,反应速率减小,
故答案为:减小;
②增大A的浓度,反应速率增大,
故答案为:增大;
③恒容下充入Ne,对参加反应的气体来说,浓度不变,则速率不变,
故答案为:不变。


科目:高中化学 来源: 题型:
【题目】碘是人体必需的微量元素之一,我国以前在食盐中加KI加工碘盐。
(1) 目前加碘食盐中,不用KI的主要原因是__________________________。
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为__________。
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O32-反应生成I-和S4O62-),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数____________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组应用下图所示的方法研究物质的性质,其中气体E的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:

(1)该项研究(实验)的主要目的是________。
(2)浓H2SO4的作用是_________。
(3)从物质性质的方面来看,这样的实验设计存在事故隐患,事故隐患是________。请在图中的D处以图像的形式表明消除事故隐患的措施_______,其中发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N的氧化物常会造成一些环境问题,科研工作者用各种化学方法来消除这些物质对环境的影响。回答下列问题:
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:①![]()
②![]()
写出CO2重整的热化学方程式___________________________。
200℃时,向VL恒温密闭容器A(恒容)、B(恒压)中,均充入1molCO2和4molH2,两容器中反应达平衡时放出或吸收的热量较多的是_________________(填“A”或“B”)。
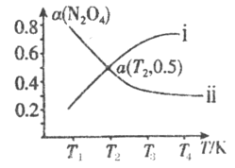
(2)在恒容密闭容器中充入一定量的N2O4,发生可逆反应![]() 。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
(3)反应![]() ,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。
,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。

(4)间接电化学法除NO,其原理如图所示。写出阴极的电极反应式(阴极室溶液呈酸性)_____________________,吸收池中除去NO的原理_______________(用离子方程式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
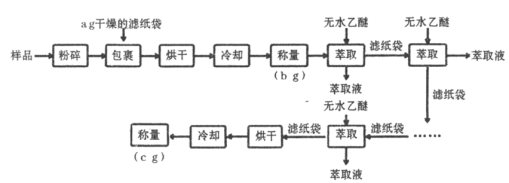
【题目】谷物中脂肪含量虽少,但却是其品质优劣的指标之一。黄玉米中粗脂肪(以亚油酸甘油酯为主)含量测定的实验流程如下:
已知:亚油酸甘油酯沸点![]() ;乙醚熔点
;乙醚熔点![]() ,沸点
,沸点![]() ,易燃。
,易燃。
回答下列问题:
(1)实验中两次“冷却”均在干燥器中进行,其目的是____________________。
(2)上述实验中多次“萃取”均在下列____________仪器中进行(填字母标号)。
|
|
|
a | b | c |
(3)为了克服多次萃取实验操作繁琐,萃取剂消耗量过大的缺点, Franz von Soxhlet发明了索氏抽提筒。若将上述实验的多次萃取改为在下图装置中进行(约需10~12h):
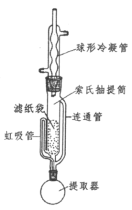
①为提高乙醚蒸气的冷凝效果,球形冷凝管可改用_____________(填仪器名称)。实验中常在冷凝管上口连接一个装有活性炭的球形干燥管,其目的是_______________。
②实验中需控制提取器(烧瓶)温度在60℃~70℃之间,应采取的加热方式是_____________________。
③索氏提取法原理:当无水乙醚加热沸腾后,蒸气通过____________(填字母标号,下同)上升,被冷凝为液体滴入抽提筒中,当液面超过________________________最高处时,萃取液即回流入提取器(烧瓶)中……如此往复。
a.冷凝管 b.虹吸管 c.连通管
④索氏提取法存在的明显缺点是__________________。
(4)数据处理:样品中纯脂肪百分含量_______________(填“<”、“>”或“=”)![]() ,原因是_______________________。
,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术。下列说法中不正确的是( )。
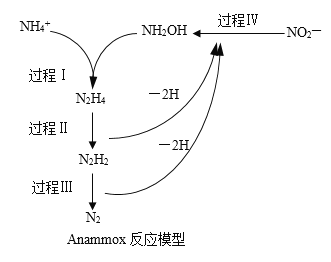
A.1mol![]() 所含的质子总数为10NA
所含的质子总数为10NA
B.联氨(N2H4)中含有极性键和非极性键
C.过程Ⅱ属于氧化反应,过程Ⅳ属于还原反应
D.过程Ⅰ中,参与反应的![]() 与NH2OH的物质的量之比为1:1
与NH2OH的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,分别向体积均为20mL、浓度均为0.1mol/L的HX、HY溶液中滴加同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。已知pOH水![]() 水(OH-),
水(OH-),![]() 水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
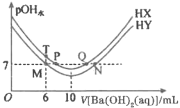
A.室温下,Ka(HX)>Ka(HY)
B.Q点溶液呈中性,溶液中c(X-)=2c(Ba2+)
C.T点溶液中阴离子浓度之和大于M点
D.室温下,水解常数Kh(Y-)=6.7×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 25℃时,同体积、浓度均为0.10molL-1的CH3COOH溶液和HX溶液,分别与同体积0.10molL-1NaHCO3溶液混合,产生CO2的体积随时间变化如图,下列说法错误的是( )
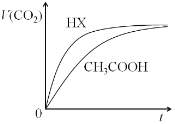
A.原溶液中c(H+):HX溶液>CH3COOH溶液
B.与CH3COOH反应结束后的溶液中c(Na+)>c(CH3COO-)
C.反应结束后两溶液中,c(CH3COO-)<c(X-)
D.由该实验可知HX为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com