
【题目】C、N的氧化物常会造成一些环境问题,科研工作者用各种化学方法来消除这些物质对环境的影响。回答下列问题:
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:①![]()
②![]()
写出CO2重整的热化学方程式___________________________。
200℃时,向VL恒温密闭容器A(恒容)、B(恒压)中,均充入1molCO2和4molH2,两容器中反应达平衡时放出或吸收的热量较多的是_________________(填“A”或“B”)。
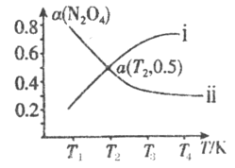
(2)在恒容密闭容器中充入一定量的N2O4,发生可逆反应![]() 。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
(3)反应![]() ,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。
,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。

(4)间接电化学法除NO,其原理如图所示。写出阴极的电极反应式(阴极室溶液呈酸性)_____________________,吸收池中除去NO的原理_______________(用离子方程式表示)。

【答案】![]() B i 204 M点
B i 204 M点![]() 的消耗速率是N点
的消耗速率是N点![]() 消耗速率的2倍,即
消耗速率的2倍,即![]() [或
[或![]() ] AD
] AD ![]()
![]()
【解析】
(1)根据盖斯定律进行计算;该反应是气体体积减小的反应,随着反应的进行,气体的压强会减小,为了保持恒压,容器的体积要减小;恒压(B)下的反应,相当于在恒容基础上将体积进行压缩,恒容条件的平衡会正向移动,据此分析热量的变化情况;
(2)由于该反应是吸热反应,随着温度的升高,平衡正向移动,N2O4的转化率增大,据此判断符合条件的曲线;根据压强之比和物质的量成正比的规律,可用压强代替物质的量列三段式进行计算,求出Kp;
(3)反应达到平衡后,正逆反应速率相等,且满足速率之比和系数成正比的规律;升高温度,化学反应速率会增加,变化后的点一定比M点、N点的速率要大,据此找到相应的变化的点;
(4)阴极得到电子发生还原反应,根据图可知是HSO3-在酸性条件下发生还原反应,生成S2O42-,据此写出其电极反应式;根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,据此写出吸收池中除去NO反应的离子方程式。
(1)反应①-2×反应②可以得到目标反应,CO2(g)+4H2(g)=CH4(g)+2H2O(g),则△H=△H1-2×△H2=(247-2×205)kJ·mol-1=-163kJ·mol-1,则CO2重整的热化学方程式CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-163kJ·mol-1;该反应是气体体积减小的反应,随着反应的进行,气体的压强会减小,为了保持恒压,容器的体积要减小;恒压(B)下的反应,相当于在恒容基础上将体积进行压缩,恒容条件的平衡会正向移动,放出的热量会更多;
(2)由于该反应是吸热反应,随着温度的升高,平衡正向移动,N2O4的转化率增大,变化曲线为图中的ⅰ;若T2K时,容器的起始压强为102kPa。恒容条件下,压强之比等于物质的量之比,因此可用压强代替物质的量进行计算。T2K时,N2O4的平衡转化率为0.5,根据三段式,有:

则平衡常数![]() ;
;
(3)N2O4的消耗速率表示的为正反应速率,NO2的消耗速率表示的为逆反应速率;在同一个化学中,用不同的物质表示化学反应速率,其速率之比等于计量数之比。在T℃时,图中M点NO2的消耗速率是N点N2O4消耗速率的2倍,即v正(NO2)=v逆(NO2)[或v正(N2O4)=v逆(N2O4)]说明反应达到平衡;升高温度,化学反应速率会增加,则M点会变成A点;达到平衡时,NO2的消耗速率是新的点N2O4消耗速率的2倍,根据图示A点表示的反应速率是D点的两倍,则对应的点分别为A、D;
(4)阴极得到电子发生还原反应,根据图可知是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是2NO+2S2O42-+2H2O=N2+4HSO3-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】无机物转化题。A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
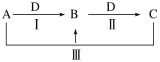
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________,B的俗名____________;
②反应Ⅱ的离子方程式是_____________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅱ的离子方程式是____________;
②反应Ⅲ的离子方程式表示反应__________;
③检验B中阳离子最好的试剂是_________(写化学式)。
(3)C与NaOH溶液反应,用离子方程式表示产生此现象的过程________、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在含有生命元素硒(![]() )的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
)的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
A.硒单质在常温下是固体
B.硒的气态氢化物稳定性比![]() 强
强
C.硒是金属元素
D.硒酸(![]() )的酸性比硫酸强
)的酸性比硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 将NaHCO3溶液滴入Ca(ClO)2溶液中 | 出现沉淀 | Ka2(H2CO3)> Ka (HClO) |
B | 将湿润的KI-淀粉试纸置于集满红棕色气体的集气瓶口 | 试纸变蓝 | 该气体为Br2 |
C | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液 | 出现沉淀 | 沉淀只有AgBr |
D | 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴的CCl4溶液中 | 溶液褪色 | 石蜡油催化裂解生成不饱和烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的
的![]() 溶液中逐滴滴加
溶液中逐滴滴加![]() 的
的![]() 溶液。溶液
溶液。溶液![]() 随滴入
随滴入![]() 溶液体积变化如图所示。下列说法正确的是( )
溶液体积变化如图所示。下列说法正确的是( )
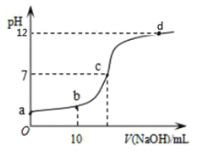
A.![]() 点的
点的![]()
B.![]() 点时,
点时,![]()
C.![]() 点时,
点时,![]()
D.从a→d,水的电离度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
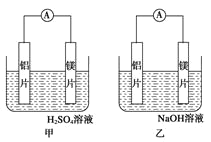
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:
实验序号 | Ⅰ | Ⅱ |
实验过程 | 滴加6滴(约0.3mL)0.01mol/LNa2S溶液
| 滴加6滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS) |
资料:ⅰ.![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法不正确的是( )。
A.根据实验可知,Na2S被氧化
B.取少量实验Ⅰ所得溶液进行实验,检测到有![]() ,不能说明S2-被
,不能说明S2-被![]() 氧化为
氧化为![]()
C.实验Ⅰ中生成棕褐色沉淀,说明酸性条件下S2-能将![]() 还原为MnO2
还原为MnO2
D.实验Ⅱ得到浅粉色沉淀,是由于S2-将新生成的![]() 还原为Mn2+并迅速与其结合所致
还原为Mn2+并迅速与其结合所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应,又属于氧化还原反应的是( )
A. NaOH溶液与盐酸中和B. Zn与CuSO4 溶液的反应
C. 分解氯酸钾制氧气D. MgCl2溶液 与KOH溶液产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com