
【题目】现在含有生命元素硒(![]() )的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
)的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
A.硒单质在常温下是固体
B.硒的气态氢化物稳定性比![]() 强
强
C.硒是金属元素
D.硒酸(![]() )的酸性比硫酸强
)的酸性比硫酸强
科目:高中化学 来源: 题型:
【题目】研究![]() 等大气污染气体的处理具有重要意义。
等大气污染气体的处理具有重要意义。
(1)已知:![]() ;
;![]() ;
;
则反应![]() 的
的![]() =________。
=________。
(2)一定条件下,将![]() 与
与![]() 以体积比
以体积比![]() 置于密闭容器中发生上述反应,测得上述反应平衡时
置于密闭容器中发生上述反应,测得上述反应平衡时![]() 与
与![]() 体积比为
体积比为![]() ,则平衡常数
,则平衡常数![]() =________(保留两位小数)。
=________(保留两位小数)。
(3)![]() 可用于合成甲醇,反应方程式为
可用于合成甲醇,反应方程式为![]() 。
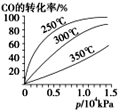
。![]() 在不同温度下的平衡转化率与压强的关系如图所示。该反应
在不同温度下的平衡转化率与压强的关系如图所示。该反应![]() ________
________![]() (填“>”或“<”)。实际生产条件控制在
(填“>”或“<”)。实际生产条件控制在![]() 、
、![]() 左右,选择此压强的理由是__________________。
左右,选择此压强的理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需的微量元素之一,我国以前在食盐中加KI加工碘盐。
(1) 目前加碘食盐中,不用KI的主要原因是__________________________。
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为__________。
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O32-反应生成I-和S4O62-),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数____________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
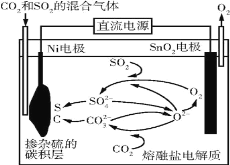
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO![]()
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中分子数相同的是( )
A.2 L CO和2 L CO2B.9 g H2O和标准状况下11.2 L CO2
C.标准状况下1 mol O2和22.4 L H2OD.0.2 mol NH3和4.48 L HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组应用下图所示的方法研究物质的性质,其中气体E的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:

(1)该项研究(实验)的主要目的是________。
(2)浓H2SO4的作用是_________。
(3)从物质性质的方面来看,这样的实验设计存在事故隐患,事故隐患是________。请在图中的D处以图像的形式表明消除事故隐患的措施_______,其中发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N的氧化物常会造成一些环境问题,科研工作者用各种化学方法来消除这些物质对环境的影响。回答下列问题:
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:①![]()
②![]()
写出CO2重整的热化学方程式___________________________。
200℃时,向VL恒温密闭容器A(恒容)、B(恒压)中,均充入1molCO2和4molH2,两容器中反应达平衡时放出或吸收的热量较多的是_________________(填“A”或“B”)。
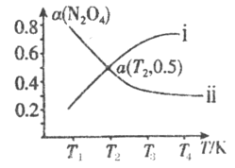
(2)在恒容密闭容器中充入一定量的N2O4,发生可逆反应![]() 。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
(3)反应![]() ,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。
,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。

(4)间接电化学法除NO,其原理如图所示。写出阴极的电极反应式(阴极室溶液呈酸性)_____________________,吸收池中除去NO的原理_______________(用离子方程式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,分别向体积均为20mL、浓度均为0.1mol/L的HX、HY溶液中滴加同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。已知pOH水![]() 水(OH-),
水(OH-),![]() 水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
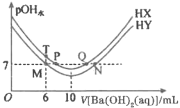
A.室温下,Ka(HX)>Ka(HY)
B.Q点溶液呈中性,溶液中c(X-)=2c(Ba2+)
C.T点溶液中阴离子浓度之和大于M点
D.室温下,水解常数Kh(Y-)=6.7×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com