
【题目】某化学课外活动小组应用下图所示的方法研究物质的性质,其中气体E的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:

(1)该项研究(实验)的主要目的是________。
(2)浓H2SO4的作用是_________。
(3)从物质性质的方面来看,这样的实验设计存在事故隐患,事故隐患是________。请在图中的D处以图像的形式表明消除事故隐患的措施_______,其中发生反应的化学方程式为__________。
【答案】探究使有色布条退色的物质 吸收气体E中的水蒸气 多余的Cl2污染空气、危害实验人员身体 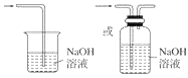 Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)探究氯气能否与水发生反应,应先除去氯气中的水蒸气,浓硫酸起到干燥氯气的作用;
(2)装置B中的有色布条不褪色,说明干燥的氯气不能使有色布条褪色,装置C中的有色布条褪色,说明氯气与水反应后的生成物使有色布条褪色;
(3)氯气有毒,为防止空气污染,应该有尾气吸收装置,可用碱溶液吸收氯气。
(1)探究氯气能否与水发生反应,应先除去氯气中的水蒸气,浓硫酸起到干燥氯气的作用,
故答案为:探究使有色布条褪色的物质;
(2)装置B中的有色布条不褪色,说明干燥的氯气不能使有色布条褪色,装置C中的有色布条褪色,说明氯气与水反应后的生成物使有色布条褪色。
故答案为:吸收气体E中的水蒸气;
(3)氯气有毒,为防止空气污染,应该有尾气吸收装置,可用碱溶液吸收氯气,发生的反应为:Cl2+2NaOH=NaCl+NaClO+H2O,尾气吸收装置图为: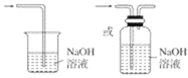 ,
,
故答案为:多余的Cl2污染空气、危害实验人员身体;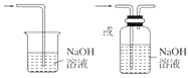 ;Cl2+2NaOH=NaCl+NaClO+H2O。
;Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量。则表示H2燃烧热的热化学方程式为_____________________。又已知:![]() ,则氨气在空气中燃烧生成液态水和氮气时的热化学方程式为______________________。
,则氨气在空气中燃烧生成液态水和氮气时的热化学方程式为______________________。
(2)氢气是合成氨的重要原料。
①当合成氨反应达到平衡后,改变某一外界条件(不改变![]() 和
和![]() 的量),反应速率与时间的关系如图所示。
的量),反应速率与时间的关系如图所示。
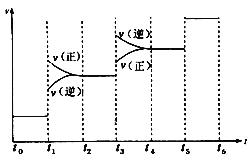
图中t1时引起平衡移动的条件可能是_______________,其中表示平衡混合物中NH3的含量最高的一段时间是______________。
②氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如![]() 等。对于反应:
等。对于反应:![]() ,在温度为
,在温度为![]() 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
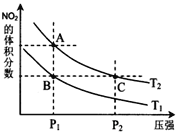
下列说法正确的是______。
a.![]() 两点的化学平衡常数:
两点的化学平衡常数:![]()
b.![]() 两点的气体颜色:
两点的气体颜色:![]() 浅,
浅,![]() 深
深
c.![]() 两点的气体平均相对分子质量:
两点的气体平均相对分子质量:![]()
d.![]() 两点的反应速率:
两点的反应速率:![]()
e.由状态B到状态A,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示:
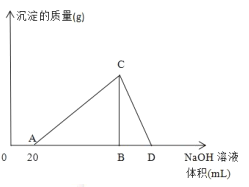
(1)写出AC段和CD段发生反应的离子方程式:
AC_______________________________________
CD_______________________________________
(2)盐酸溶液的浓度是____________________。
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是__________________。
(4)D点表示的氢氧化钠溶液的体积是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在含有生命元素硒(![]() )的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
)的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
A.硒单质在常温下是固体
B.硒的气态氢化物稳定性比![]() 强
强
C.硒是金属元素
D.硒酸(![]() )的酸性比硫酸强
)的酸性比硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下![]() 碳酸氢钠溶液的
碳酸氢钠溶液的![]() 为8.4,则下列说法正确的是( )
为8.4,则下列说法正确的是( )
A.加入少量![]() 固体,钠离子和碳酸根离子浓度均增大
固体,钠离子和碳酸根离子浓度均增大
B.将该溶液加水稀释,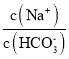 的比值保持不变
的比值保持不变
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 将NaHCO3溶液滴入Ca(ClO)2溶液中 | 出现沉淀 | Ka2(H2CO3)> Ka (HClO) |
B | 将湿润的KI-淀粉试纸置于集满红棕色气体的集气瓶口 | 试纸变蓝 | 该气体为Br2 |
C | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液 | 出现沉淀 | 沉淀只有AgBr |
D | 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴的CCl4溶液中 | 溶液褪色 | 石蜡油催化裂解生成不饱和烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的
的![]() 溶液中逐滴滴加
溶液中逐滴滴加![]() 的
的![]() 溶液。溶液
溶液。溶液![]() 随滴入
随滴入![]() 溶液体积变化如图所示。下列说法正确的是( )
溶液体积变化如图所示。下列说法正确的是( )
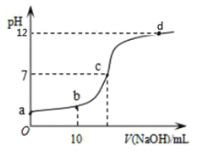
A.![]() 点的
点的![]()
B.![]() 点时,
点时,![]()
C.![]() 点时,
点时,![]()
D.从a→d,水的电离度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com