
【题目】下列各组物质中分子数相同的是( )
A.2 L CO和2 L CO2B.9 g H2O和标准状况下11.2 L CO2
C.标准状况下1 mol O2和22.4 L H2OD.0.2 mol NH3和4.48 L HCl气体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,进行导电性实验,图1灯泡不亮,图2灯泡亮,下列结论正确的是

A.NaCl是非电解质B.NaCl晶体中不存在离子
C.NaCl在水中电离出了可以自由移动的离子D.NaCl溶液是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火电站是电力的主要来源之一,火电站是利用煤燃烧进行发电,同时产生污染物。下图是火电站的工作示意图:下列叙述不正确的是( )

A.火电站产生的SO2、NO2等气体能形成酸雨
B.加高火电站的烟囱可减少尾气中CO的含量
C.静电沉淀器除尘利用了胶体的性质
D.向煤中加入CaO,可以减少SO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用112 L(标准状况)氯气与足量石灰乳反应,制得的漂白粉中有效成分Ca(ClO)2的最大含量为___________mol。
(2)向一定量石灰乳中缓慢通入氯气,随着反应的进行,温度升高,开始产生Ca(ClO3)2。体系中ClO-和ClO3-的物质的量(n)与反应时间(t)的关系曲线如图1所示(不考虑氯气和水的反应)。
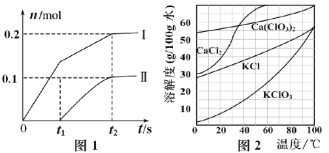
①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为_____________。
②该反应过程中消耗Ca(OH)2的质量为_____________。
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,如图2,从该溶液中分离出KClO3固体的实验方法是________________(不要求填具体操作步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组在实验室中对铁盐与亚铁盐的相互转化进行如下探究。
已知:SCN-具有强还原性,易被氧化为(SCN)2。
实验Ⅰ:Fe3+转化为Fe2+
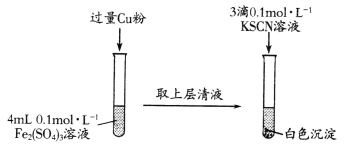
(1)Fe2(SO4)3溶液与Cu粉发生反应的离子方程式为________________________。
(2)探究白色沉淀产生的原因:
①提出假设:
假设1:白色沉淀是Fe2+与SCN-直接结合所得;
假设2:白色沉淀是Cu2+与SCN-直接结合所得;
假设3:_____________________________________________。
②实验验证:
向CuSO4溶液中通人过量SO2,将Cu2+还原,再加入KSCN溶液,观察到有白色沉淀生成,证明假设三成立。写出CuSO4溶液与KSCN溶液反应的离子方程式:________。
实验Ⅱ:Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol·L-1 FeSO4溶液中加入3mL 4mol·L-1稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
(3)实验Ⅱ中,Fe2+转化为Fe3+的离子方程式是_____________________________。
(4)设计如下实验,探究溶液变为棕色的原因:
①向Fe2(SO4)3溶液中通入NO,溶液颜色无变化
②向FeSO4溶液中通入NO,溶液颜色变为棕色
③向Fe(NO3)3溶液中通入NO,溶液颜色无变化
由上述实验分析溶液变为棕色的原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
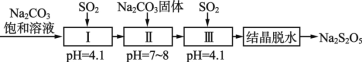
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1000molL-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000molL-1NaOH溶液、0.1000molL-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法不正确的是( )
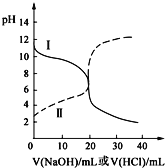
A. 根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3H2O)≈10-5
B. 当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
C. 曲线I表示的滴定过程一般选择甲基橙作指示剂
D. 在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com