
ЎҫМвДҝЎҝГәИјЙХЕЕ·ЕөДСМЖшЦРә¬УРSO2Ј¬ТЧРОіЙЛбУкЎўОЫИҫҙуЖшЎЈУРР§ИҘіэәНАыУГSO2КЗ»·ҫіұЈ»ӨөДЦШТӘТйМвЎЈ
ЈЁ1Ј©Л«јо·ЁПҙіэSO2ЎЈNaOHИЬТә![]() Na2SO3ИЬТә
Na2SO3ИЬТә
ўЩЙПКц№эіМЙъіЙNa2SO3өДАлЧУ·ҪіМКҪОӘ_________ЎЈ
ўЪЛ«јо·ЁПҙіэSO2өДУЕөгОӘ_________ЎЈ
ЈЁ2Ј©NaClO2Сх»Ҝ·ЁОьКХSO2ЎЈПтNaClO2ИЬТәЦРНЁИлә¬УРSO2өДСМЖшЈ¬·ҙУҰОВ¶ИОӘ323 KЈ¬·ҙУҰТ»¶ОКұјдЎЈ
ўЩЛжЧЕОьКХ·ҙУҰөДҪшРРЈ¬ОьКХјБИЬТәөДpHЦрҪҘ_________ЈЁМоЎ°ФцҙуЎұЎ°І»ұдЎұ»тЎ°јхРЎЎұЈ©ЎЈ
ўЪИз№ыІЙУГNaClOМжҙъNaClO2Ј¬ТІДЬөГөҪҪПәГөДСМЖшНСБтР§№ыЎЈОьКХөИБҝөДSO2Ј¬ЛщРиNaClOөДОпЦКөДБҝКЗNaClO2өД_________ұ¶ЎЈ
ЈЁ3Ј©SO2өДАыУГЎЈЙъІъҪ№СЗБтЛбДЖ(Na2S2O5)Ј¬НЁіЈКЗУЙNaHSO3№эұҘәНИЬТәҫӯҪбҫ§НСЛ®ЦЖөГЎЈАыУГСМөАЖшЦРөДSO2ЙъІъNa2S2O5өД№ӨТХИзПВЈә
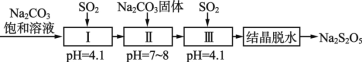
ўЩўсЦР·ҙУҰөД»ҜС§·ҪіМКҪОӘ___________ЎЈ
ўЪИфўуЦРНЁИлSO2І»ЧгЈ¬Ҫбҫ§НСЛ®өГөҪөДNa2S2O5ЦР»мУРөДЦчТӘФУЦККЗ_______ЈЁМо»ҜС§КҪЈ©ЎЈ
ўЫ№ӨТХЦРјУИлNa2CO3№ММеЈ¬ІўФЩҙОідИлSO2өДДҝөДКЗ_________ЎЈ
Ўҫҙр°ёЎҝ2OHЈӯЈ«SO2=SO32-Ј«H2O УГCaOҝЙК№NaOHФЩЙъ јхРЎ 2 Na2CO3+2SO2+H2O=2NaHSO3+CO2 Na2SO3 өГөҪNaHSO3№эұҘәНИЬТә
ЎҫҪвОцЎҝ
ЈЁ1Ј©ўЩSO2УлNaOH·ҙУҰЈ¬ЙъіЙNa2SO3әНH2OЈ¬ҫЭҙЛРҙіцАлЧУ·ҪіМКҪЈ»
ўЪЛ«јо·ЁПҙіэSO2өДУЕөгОӘCaOҝЙК№NaOHФЩЙъЈ»
ЈЁ2Ј©ўЩОьКХјБИЬТә·ўЙъөД·ҙУҰОӘClO2-+2SO2+2H2O=Cl-+2SO42-+4H+Ј¬·ҙУҰІъЙъЗвАлЧУЈ¬ЛщТФИЬТәөДpHЦрҪҘјхРЎЈ»
ўЪёщҫЭClO2-+2SO2+2H2O=Cl-+2SO42-+4H+әНClO-+SO2+H2O=Cl-+SO42-+2H+ҪшРР·ЦОцЈ»
ЈЁ3Ј©ўЩўсЦРЈ¬pH=4.1Ј¬ЛөГч·ҙУҰЙъіЙЛбРФОпЦКЈ¬Ц»ДЬОӘNaHSO3Ј¬ҫЭҙЛМхјюРҙіц»ҜС§·ҪіМКҪЈ»
ўЪИфўуЦРНЁИлSO2І»ЧгЈ¬ФтИЬТәОӘNa2SO3әНNaHSO3өД»мәПОпЈ¬Ҫбҫ§НСЛ®өГөҪөДNa2S2O5ЦР»мУРөДЦчТӘФУЦККЗNa2SO3Ј»
ўЫНЁ№эМвёЙРЕПўҝЙЦӘЎ°ЙъІъҪ№СЗБтЛбДЖ(Na2S2O5)Ј¬НЁіЈКЗУЙNaHSO3№эұҘәНИЬТәҫӯҪбҫ§НСЛ®ЦЖөГЎұЈ¬ҫЭҙЛҪшРР·ЦОцЎЈ
ЈЁ1Ј©ўЩSO2УлNaOH·ҙУҰЈ¬ЙъіЙNa2SO3әНH2OЈ¬·ҙУҰөДАлЧУ·ҪіМКҪОӘ2OHЈӯЈ«SO2=SO32-Ј«H2OЈ»
ҙр°ёОӘЈә2OHЈӯЈ«SO2=SO32-Ј«H2OЈ»
ўЪЛ«јо·ЁПҙіэSO2өДУЕөгОӘCaOҝЙК№NaOHФЩЙъЈ»
ҙр°ёОӘЈәCaOҝЙК№NaOHФЩЙъЈ»
ЈЁ2Ј©ўЩЛжЧЕОьКХ·ҙУҰөДҪшРРЈ¬ОьКХјБИЬТә·ўЙъөД·ҙУҰОӘClO2-+2SO2+2H2O=Cl-+2SO42-+4H+Ј¬ЛщТФИЬТәөДpHЦрҪҘјхРЎЈ»
ҙр°ёОӘЈәјхРЎЈ»
ўЪИз№ыІЙУГNaClOМжҙъNaClO2Ј¬·ҙУҰөДАлЧУ·ҪіМКҪОӘClO-+SO2+H2O=Cl-+SO42-+2H+Ј»ёщҫЭClO2-+2SO2+2H2O=Cl-+2SO42-+4H+·ҙУҰҝЙЦӘЈ¬ОьКХөИБҝөДSO2Ј¬ЛщРиNaClOөДОпЦКөДБҝКЗNaClO2өД2ұ¶Ј»
ҙр°ёОӘЈә2Ј»
ЈЁ3Ј©ўЩўсЦРЈ¬pH=4.1Ј¬ЛөГч·ҙУҰЙъіЙЛбРФОпЦКЈ¬Ц»ДЬОӘNaHSO3Ј¬·ҙУҰөД»ҜС§·ҪіМКҪОӘNa2CO3+2SO2+H2O=2NaHSO3+CO2Ј»
ҙр°ёОӘЈәNa2CO3+2SO2+H2O=2NaHSO3+CO2 Ј»
ўЪИфўуЦРНЁИлSO2І»ЧгЈ¬ФтИЬТәОӘNa2SO3әНNaHSO3өД»мәПОпЈ¬Ҫбҫ§НСЛ®өГөҪөДNa2S2O5ЦР»мУРөДЦчТӘФУЦККЗNa2SO3Ј»
ҙр°ёОӘЈәNa2SO3Ј»
ўЫМвёЙРЕПўёжЛЯОТГЗЎ°ЙъІъҪ№СЗБтЛбДЖ(Na2S2O5)Ј¬НЁіЈКЗУЙNaHSO3№эұҘәНИЬТәҫӯҪбҫ§НСЛ®ЦЖөГЎұЎЈ№ӨТХЦРјУИлNa2CO3№ММеЈ¬ІўФЩҙОідИлSO2өДДҝөДЈ¬ПФИ»КЗОӘБЛЧоЦХ»сөГNaHSO3№эұҘәНИЬТәЈ»
№Кҙр°ёОӘЈәөГөҪNaHSO3№эұҘәНИЬТәЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝNAКЗ°ў·ьјУөВВЮіЈКэөДЦөЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
A.іЈОВіЈС№ПВЈ¬11.2 LHClЖшМеЦРә¬УРөД·ЦЧУКэОӘ0.5NA
B.50 mL12 mol/LСОЛбУлЧгБҝFe·ҙУҰЈ¬ЧӘТЖөзЧУКэОӘ0.3NA
C.Ҫ«0.2 mol FeCl3ЦЖіЙҪәМеЈ¬ЛщөГҪәМеБЈЧУКэОӘ0.2NA
D.іЈОВіЈС№ПВЈ¬5.6 g N2әНCO»мәПОпЦРЛщә¬УРөДФӯЧУКэОӘ0.4NA
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРёчЧйОпЦКЦР·ЦЧУКэПаН¬өДКЗ(ЎЎЎЎ )
A.2 L COәН2 L CO2B.9 g H2OәНұкЧјЧҙҝцПВ11.2 L CO2
C.ұкЧјЧҙҝцПВ1 mol O2әН22.4 L H2OD.0.2 mol NH3әН4.48 L HClЖшМе
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДЬјшұр NH4ClЎўNa2SO4Ўў(NH4)2SO4ЎўKCl ЛДЖҝОЮЙ«ИЬТәөДКФјБКЗ
A. Ba(OH)2ИЬТә B. AgNO3ИЬТә C. Ba(NO3)2ИЬТә D. NaOHИЬТә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЈЁ1Ј©ҪсУРОеЦЦОпЦКЈәўЩНӯПЯ ўЪИЫ»ҜөДNaCl ўЫNaClҫ§Ме ўЬ°ұЖш ўЭТәМ¬ВИ»ҜЗвЈ¬ЖдЦРДЬөјөзөДОпЦККЗ__Ј»КфУЪөзҪвЦКөДКЗ___Ј»КфУЪ·ЗөзҪвЦКөДКЗ___ЎЈ
ЈЁ2Ј©0.5molH2SO4өДЦКБҝКЗ__gЈ¬ДЬЦРәН___molNaOHЈ¬ёГБтЛбЛщә¬ЗвФӘЛШөДЦКБҝУл___molNH3ЦРЛщә¬ЗвФӘЛШөДЦКБҝПаН¬ЎЈ
ЈЁ3Ј©ПаН¬ЦКБҝөДCH4әНH2SЦР·ЦЧУёцКэұИОӘ___ЎЈ
ЈЁ4Ј©ФЪKClЎўMgCl2ЎўMg(NO3)2РОіЙөД»мәПИЬТәЦРЈ¬n(K+)=0.2molЈ¬n(Mg2+)=0.15molЈ¬n(Cl-)=0.2molЈ¬Фтn(NO3-)ОӘЈЁ_____Ј©
AЈ®0.05mol BЈ®0.20mol CЈ®0.30mol DЈ®0.40mol
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝә¬ЕрЎўөӘЎўБЧЎўНӯЎўРҝөД»ҜәПОпУРРн¶аЦШТӘУГНҫЎЈ»ШҙрПВБРОКМвЈә
ЈЁ1Ј©»щМ¬BФӯЧУөзЧУХјҫЭЧоёЯДЬј¶өДөзЧУФЖВЦАӘНјОӘ____Ј»»щМ¬Cu+өДәЛНвөзЧУЕЕІјКҪОӘ___ЎЈ
ЈЁ2Ј©»ҜәПОп(CH3)3NДЬИЬУЪЛ®өДФӯТтКЗ______ЎЈ
ЈЁ3Ј©СЗБЧЛбЈЁH3PO3Ј©КЗБЧФӘЛШөДТ»ЦЦә¬СхЛбЈ¬УлNaOH·ҙУҰЦ»ЙъіЙNaH2PO3әНNa2HPO3БҪЦЦСОЈ¬ФтH3PO3·ЦЧУөДҪб№№КҪОӘ____ЎЈ
ЈЁ4Ј©Zn2+ҝЙУлCNЈӯЎў¶юұҪБтлкЈЁ![]() Ј©өИРОіЙОИ¶ЁЕдәПОпЎЈ
Ј©өИРОіЙОИ¶ЁЕдәПОпЎЈ
ўЩCNЈӯ өДҪб№№КҪОӘ_____ЎЈ
ўЪГҝёц¶юұҪБтлк·ЦЧУЦРЈ¬ІЙИЎsp2ФУ»ҜөДФӯЧУУР__ёцЎЈ
ЈЁ5Ј©Вұ»ҜРҝөДИЫөгИзұнЛщКҫЈә
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
ИЫөг/Ўж | 872 | 275 | 394 | 446 |
ZnF2өДИЫөгФ¶ёЯУЪЖдЛьИэЦЦВұ»ҜРҝЈ¬ЖдФӯТтОӘ_____ЎЈ
ЈЁ6Ј©БЧ»ҜЕрКЗТ»ЦЦДНДҘНҝБПЈ¬ЛьҝЙУГЧчҪрКфөДұнГжұЈ»ӨІгЎЈБЧ»ҜЕрҫ§Меҫ§°ыИзНј1ЛщКҫЈә
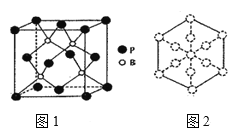
ўЩБЧ»ҜЕрҫ§°ыСШЧЕМе¶ФҪЗПЯ·ҪПтөДН¶У°ИзНј2Ј¬ЗлФЪҙрМвҝЁЙПҪ«ұнКҫBФӯЧУөДФІИҰНҝәЪ____ЎЈ
ўЪТСЦӘБЧ»ҜЕрҫ§МеөДГЬ¶ИОӘҰС g/cm3Ј¬°ў·ьјУөВВЮіЈКэОӘNAЈ¬ФтBЎӘPјьіӨОӘ___pmЈЁБРіцјЖЛгКҪјҙҝЙЈ©ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРРрКцХэИ·өДКЗ(ЎЎЎЎ)
A. ҙОВИЛбөДөзАл·ҪіМКҪОӘHClO===HЈ«Ј«ClOЈӯ
B. pH=7өДИЬТәТ»¶ЁКЗЦРРФИЬТә
C. ФЪCH3COONaИЬТәЦРЈ¬c(CH3COOЈӯ)Јјc(NaЈ«)
D. 0.2 molЎӨLЈӯ1CH3COOHИЬТәЦРөДc(HЈ«)КЗ0.1 molЎӨLЈӯ1 HClИЬТәЦРөДc(HЈ«)өД2ұ¶
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПт20mLДіОпЦКөДБҝЕЁ¶ИөДAlCl3ИЬТәЦРөОјУ2mol/LNaOHИЬТәКұЈ¬ЦрөОјУИлNaOHИЬТәЦұЦБ№эБҝЎЈҫӯІв¶ЁЈ¬јУИлөДNaOHИЬТәөДМе»эЈЁmLЈ©әНЛщөГіБөнөДОпЦКөДБҝЈЁmolЈ©өД№ШПөИзНјЛщКҫЎЈФтЈә

ЈЁ1Ј©РҙіцOA¶О·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪЈәOA¶О___Ј¬НјЦРПЯ¶ОOPЈәPB=__Ј¬
ЈЁ2Ј©јЖЛгФӯAlCl3ИЬТәөДОпЦКөДБҝЕЁ¶ИОӘ__mol/LЈ¬
ЈЁ3Ј©НјЦРA¶ФУҰөДәбЧшұкОӘ__mLЈ¬
ЈЁ4Ј©өұјУИл5mLNaOHИЬТәКұЈ¬ІъЙъіБөнБҝОӘ__molЈ¬
ЈЁ5Ј©өұјУИлөДNaOHИЬТә№эБҝКұЈ¬К№ЧоіхЙъіЙөДіБөнІҝ·ЦИЬҪвЈ¬ТӘөГөҪУлЈЁ4Ј©ЦРПаН¬өДіБөнБҝЈ¬јУИлNaOHИЬТәөДМе»эОӘ__mLЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјЛщКҫКЗЧйіЙИЛМеПё°ыөДЦчТӘФӘЛШј°ЖдұИАэЈәПВБРПа№ШРрКцЦРЈ¬ҙнОуөДКЗЈЁ Ј©

A.ЧйіЙИЛМеПё°ыөДЦчТӘФӘЛШКЗМјЎўЗвЎўСхЎўөӘЎўБЧөИ
B.ФЪИЛМеПё°ыЦРә¬БҝЧо¶аөДФӘЛШКЗСх
C.№№іЙИЛМеПё°ыөДЧо»щұҫФӘЛШКЗМј
D.ЖдЛыФӘЛШә¬БҝРЎУЪ3%Ј¬ЛщТФЧчУГТІәЬРЎ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com