
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示。则:

(1)写出OA段发生反应的离子方程式:OA段___,图中线段OP:PB=__,
(2)计算原AlCl3溶液的物质的量浓度为__mol/L,
(3)图中A对应的横坐标为__mL,
(4)当加入5mLNaOH溶液时,产生沉淀量为__mol,
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为__mL。
【答案】Al3++3OH﹣=Al(OH)3↓ 3:1 0.5 15 0.0033(或![]() ) 18.33(或
) 18.33(或![]() )
)
【解析】
向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量,过程中发生的反应为①Al3++3OH-=Al(OH)3↓,②Al(OH)3+OH-=AlO2-+2H2O,图象中OA段为发生反应①,AB段为氢氧化铝溶解发生反应②,依据各步反应分析判断,进行有关计算。
(1)依据分析可知OA段发生的反应是氯化铝和氢氧化钠反应生成氢氧化铝沉淀至最大量的过程,反应离子方程式为:Al3++3OH-=Al(OH)3↓; AB段发生的是氢氧化铝溶解在氢氧化钠溶液中至沉淀全部溶解,根据反应①Al3++3OH-=Al(OH)3↓,②Al(OH)3+OH-=AlO2-+2H2O得到生成最大量沉淀和沉淀全部溶解所消耗氢氧化钠物质的量之比为3:1,氢氧化钠溶液浓度一定,所以消耗的NaOH溶液体积比为3:1,
故答案为:Al3++3OH-=Al(OH)3↓;3:1;
(2)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,根据Al守恒,所以氯化铝物质的量为0.01mol,氯化铝溶液浓度=![]() =0.5mol/L,
=0.5mol/L,
故答案为:0.5;
(3)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,所以消耗氢氧化钠物质的量为0.03mol,氢氧化钠溶液的体积=![]() =
=![]() =0.015L=15mL,
=0.015L=15mL,
故答案为:15;
(4)当加入5mLNaOH溶液时,产生沉淀量依据反应Al3++3OH-=Al(OH)3↓;计算得到:
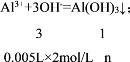
n=0.0033mol(或![]() mol),
mol),
故答案为:0.0033(或![]() );
);
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,则发生反应Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,最大量沉淀为0.01mol,消耗氢氧化钠物质的量为0.03mol,溶解的沉淀物质的量=0.01mol0.0033mol=0.0067mol,溶解0.0067mol氢氧化铝消耗氢氧化钠为0.0067mol;所以共消耗氢氧化钠物质的量=0.0067mol+0.03mol=0.0367mol;需要氢氧化钠溶液体积=![]() =0.01833L=18.35mL[或
=0.01833L=18.35mL[或![]() mL(依据沉淀量为
mL(依据沉淀量为![]() mol计算)];
mol计算)];
故答案为:18.35(或![]() )。
)。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】火电站是电力的主要来源之一,火电站是利用煤燃烧进行发电,同时产生污染物。下图是火电站的工作示意图:下列叙述不正确的是( )

A.火电站产生的SO2、NO2等气体能形成酸雨
B.加高火电站的烟囱可减少尾气中CO的含量
C.静电沉淀器除尘利用了胶体的性质
D.向煤中加入CaO,可以减少SO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
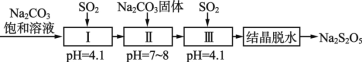
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。有关说法正确的是
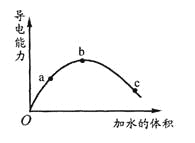
A. a、b、c三点溶液的pH:a>b>c
B. 若使C点的c(CH3COO-)增大,溶液的pH也增大,可加入适量的CH3COONa固体
C. a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D. 用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量之比为
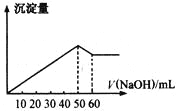
A.6:1B.3:1C.2:1D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1000molL-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000molL-1NaOH溶液、0.1000molL-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法不正确的是( )
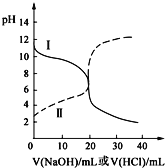
A. 根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3H2O)≈10-5
B. 当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
C. 曲线I表示的滴定过程一般选择甲基橙作指示剂
D. 在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
(1)下图中所示反应是________(填“吸热”或“放热”)反应。

(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会____(填“放出”或“吸收”)____kJ的热量。
(3)下列反应中,属于放热反应的是________,属于吸热反应的是________。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于强电解质的是___,属于弱电解质的是__,属于非电解质的是__。(填序号)
①氨气 ②醋酸钠 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氢氟酸 ⑦乙醇
(2)一定条件下,醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+ΔH>0
CH3COO-+H+ΔH>0
①下列方法中,可使0.10mol·L-1醋酸溶液中CH3COOH电离平衡向左移的是___。
a.加入少量0.10mol·L-1的稀盐酸 b.加热
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
②已知在25℃时,醋酸和亚硫酸的电离平衡常数分别为:醋酸:K=1.75×10-5,亚硫酸:K1=1.54×10-2 K2=1.02×10-7,则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH___H2SO3(填“>”、“<”或“=”)。
③25℃时,向0.10mol·L-1CH3COOH溶液中加入少量盐酸,使溶液中[OH-]=5.0×10-13mol·L-1,则该溶液的pH=__。(已知:lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com