
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B.50 mL12 mol/L盐酸与足量Fe反应,转移电子数为0.3NA
C.将0.2 mol FeCl3制成胶体,所得胶体粒子数为0.2NA
D.常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)标准状况下11.2L,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为___;此混合气体完全燃烧,将燃烧产物通过足量过氧化钠后,固体增重___g。
(2)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是___。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是( )
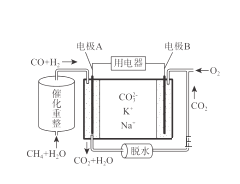
A. 反应CH4+3H2O 3H2+CO消耗1mol CH4转移4mol电子
3H2+CO消耗1mol CH4转移4mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
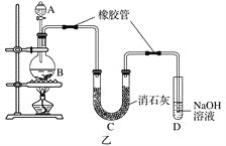
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。
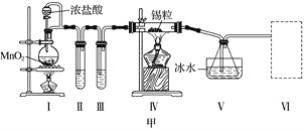
(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
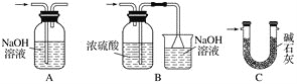
②Ⅵ处装置最好选用________(填字母)。
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:__________; ②NaHSO4__________
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________
(2)相同物质的量的O2和O3的质量比__________,分子个数比为 __________,所含氧原子的个数比为__________
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤 C 萃取 D 蒸馏 E 蒸发结晶 F 高温分解
①分离CCl4和H2O__________;
②除去澄清石灰水中悬浮的CaCO3:__________;
③除去CaO固体中少量的CaCO3固体__________;
④从碘水中提取碘__________;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,进行导电性实验,图1灯泡不亮,图2灯泡亮,下列结论正确的是

A.NaCl是非电解质B.NaCl晶体中不存在离子
C.NaCl在水中电离出了可以自由移动的离子D.NaCl溶液是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火电站是电力的主要来源之一,火电站是利用煤燃烧进行发电,同时产生污染物。下图是火电站的工作示意图:下列叙述不正确的是( )

A.火电站产生的SO2、NO2等气体能形成酸雨
B.加高火电站的烟囱可减少尾气中CO的含量
C.静电沉淀器除尘利用了胶体的性质
D.向煤中加入CaO,可以减少SO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
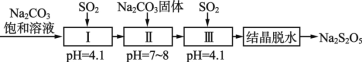
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com