
【题目】(1)今有五种物质:①铜线 ②熔化的NaCl ③NaCl晶体 ④氨气 ⑤液态氯化氢,其中能导电的物质是__;属于电解质的是___;属于非电解质的是___。
(2)0.5molH2SO4的质量是__g,能中和___molNaOH,该硫酸所含氢元素的质量与___molNH3中所含氢元素的质量相同。
(3)相同质量的CH4和H2S中分子个数比为___。
(4)在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,n(K+)=0.2mol,n(Mg2+)=0.15mol,n(Cl-)=0.2mol,则n(NO3-)为(_____)
A.0.05mol B.0.20mol C.0.30mol D.0.40mol
【答案】①② ②③⑤ ④ 49g 1mol 0.333(1/3) 17:8 C
【解析】
(1)金属、石墨能导电,电解质在水溶液或熔化状态下能够导电;电解质在水溶液或熔化状态下能够导电的化合物;非电解质是指在水溶液里和熔化状态下都不能导电的化合物;
(2)根据m=nM计算、1mol硫酸消耗2mol氢氧化钠,结合分子中氢原子的物质的量计算;
(3)分子个数之比等于物质的量之比,结合n=![]() 计算;
计算;
(4)溶液呈电中性,溶液中c(K+)+2c(Mg2+)=c(Cl-)+c(NO3-),据此计算。
(1)①铜线是金属单质,能导电,但是既不是电解质也不是非电解质;
②熔化的NaCl能导电,属于化合物,属于电解质;
③NaCl晶体不能导电,溶于水或熔融状态下能导电,属于电解质;
④氨气不能导电,在水溶液和熔化状态下自身都不能够导电,是非电解质;
⑤液态氯化氢不能导电,溶于水能导电,属于电解;
则能导电的物质是①②;属于电解质的是②③⑤;属于非电解质的是④;
(2)0.5molH2SO4的质量是0.5mol×98g/mol=49g;硫酸与NaOH反应消耗的氢氧化钠的物质的量是硫酸的二倍,则NaOH为1mol;0.5 molH2SO4中H的物质的量为1mol,含有1molH的NH3的物质的量为![]() mol;
mol;
(3)相同质量的CH4和H2S的物质的量与摩尔质量成反比,则其分子个数比=物质的量之比=34g/mol:16g/mol=17:8;
(4)溶液呈电中性,溶液中c(K+)+2c(Mg2+)=c(Cl-)+c(NO3-),则:0.2mol/L+2×0.15mol/L=0.2mol/L+c(NO3-),解得c(NO3-)=0.3mol/L,故答案为C。


科目:高中化学 来源: 题型:
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。
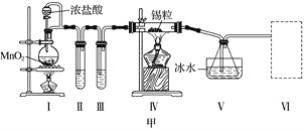
(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
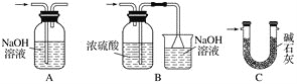
②Ⅵ处装置最好选用________(填字母)。
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
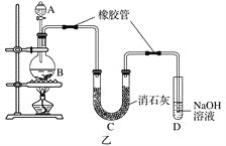
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用112 L(标准状况)氯气与足量石灰乳反应,制得的漂白粉中有效成分Ca(ClO)2的最大含量为___________mol。
(2)向一定量石灰乳中缓慢通入氯气,随着反应的进行,温度升高,开始产生Ca(ClO3)2。体系中ClO-和ClO3-的物质的量(n)与反应时间(t)的关系曲线如图1所示(不考虑氯气和水的反应)。
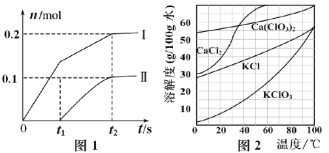
①t2时刻后,溶液中ClO-和ClO3-的物质的量之比为_____________。
②该反应过程中消耗Ca(OH)2的质量为_____________。
(3)向Ca(ClO3)2浓溶液中加入稍过量的KCl固体可转化为KClO3,如图2,从该溶液中分离出KClO3固体的实验方法是________________(不要求填具体操作步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是

A. 化学式可以表示为KFe2(CN)6
B. 每一个立方体中平均含有24个π键
C. 普鲁士蓝不属于配位化合物
D. 每个Fe3+周围与之相邻的Fe2+离子有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
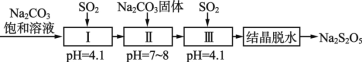
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 已知2CO(g)+O2(g)=2CO2(g) △H= -566.0kJmol﹣1则该反应的反应热为566.0kJmol-1
B. 甲烷的燃烧热△H= -890kJmol-1,则甲烷燃烧的热化学方程式为CH4(g)+O2(g)=CO2(g)+2H2O(g) △H= -890kJmol-1
C. 在一定条件下将1mol SO2和0.5mol O2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) △H= -158.4kJmol-1
2SO3(g) △H= -158.4kJmol-1
D. 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H= -57.3kJmol-1,但稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量小于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量之比为
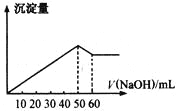
A.6:1B.3:1C.2:1D.1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com