
【题目】下列说法中正确的是( )
A. 已知2CO(g)+O2(g)=2CO2(g) △H= -566.0kJmol﹣1则该反应的反应热为566.0kJmol-1
B. 甲烷的燃烧热△H= -890kJmol-1,则甲烷燃烧的热化学方程式为CH4(g)+O2(g)=CO2(g)+2H2O(g) △H= -890kJmol-1
C. 在一定条件下将1mol SO2和0.5mol O2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) △H= -158.4kJmol-1
2SO3(g) △H= -158.4kJmol-1
D. 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H= -57.3kJmol-1,但稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量小于57.3kJ
科目:高中化学 来源: 题型:
【题目】Ⅰ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请 回答下列问题:
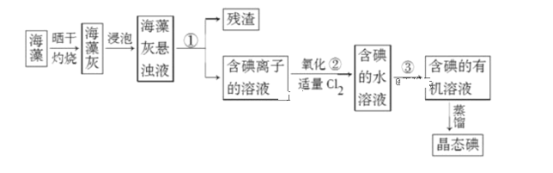
(1)指出提取碘的过程中有关实验操作①和③的名称:________;________。
(2)在 3 mL 碘水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________ (注:试管中深色区为紫红色溶液)。

(3)最后一步蒸馏制得晶态碘时,发现冷凝到锥形瓶中的有机物呈淡紫色,推测其原因是__________
Ⅱ.欲配制 480mL0.5mol·L-1 的 NaOH 溶液,试回答下列问题。
(4)配制上述溶液需要的仪器有:药匙、托盘天平、量筒、玻璃棒、________。
(5)某学生实际配制的 NaOH 溶液的浓度为 0.51mol·L-1,原因可能是_________。
A 使用滤纸称量 NaOH 固体 B 容量瓶中原来存有少量水
C 溶解后的烧杯未经多次洗涤 D 用胶头滴管加水定容时俯视刻度
E 加水时超过刻度线,用胶头滴管吸出 F 转移溶液之前未经冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq) ![]() Na(s)
Na(s) ![]() Na2O2(s)
Na2O2(s)
B.SiO2(s) ![]() Si(s)
Si(s) ![]() SiCl4(l)
SiCl4(l)
C.SO2(g) ![]() NH4HSO3(aq)
NH4HSO3(aq) ![]() (NH4)2SO4(aq)
(NH4)2SO4(aq)
D.Cu2(OH)2CO3(s) ![]() CuO(s)
CuO(s) ![]() Cu(OH)2(s)
Cu(OH)2(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今有五种物质:①铜线 ②熔化的NaCl ③NaCl晶体 ④氨气 ⑤液态氯化氢,其中能导电的物质是__;属于电解质的是___;属于非电解质的是___。
(2)0.5molH2SO4的质量是__g,能中和___molNaOH,该硫酸所含氢元素的质量与___molNH3中所含氢元素的质量相同。
(3)相同质量的CH4和H2S中分子个数比为___。
(4)在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,n(K+)=0.2mol,n(Mg2+)=0.15mol,n(Cl-)=0.2mol,则n(NO3-)为(_____)
A.0.05mol B.0.20mol C.0.30mol D.0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸锰(MnSO4H2O)是一种重要的化工中间体,工业上可由高铁菱锰矿(主要成分为MnCO3,含有FeCO3、Al2O3、MgO、CaO、SiO2等杂质)制备,部分工艺流程如下:
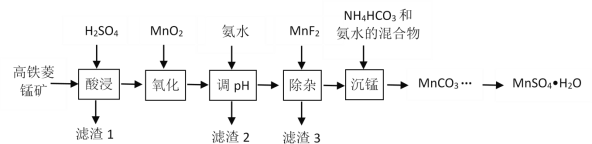
相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“酸浸”时高铁菱锰矿需要粉碎,并进行充分搅拌,为提高锰的浸出率还可采取的措施有_________。(写出其中一种)
(2)“氧化”时发生反应的化学方程式为________。
(3)“调pH”范围至5~6,得到滤渣2的主要成分除MnO2外还有_________。
(4)“除杂”过程中加入MnF2的目的是_________。已知:Ksp(MgF2)=5.16×10-11,Ksp(CaF2)=5.3×10-9。
(5)“沉锰”过程中发生反应的离子方程式为_________。
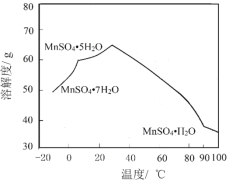
(6)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O 晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。晶体烘干时温度不能过高的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 次氯酸的电离方程式为HClO===H++ClO-
B. pH=7的溶液一定是中性溶液
C. 在CH3COONa溶液中,c(CH3COO-)<c(Na+)
D. 0.2 mol·L-1CH3COOH溶液中的c(H+)是0.1 mol·L-1 HCl溶液中的c(H+)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向50mL 1mol·L-1的盐酸中加入烧碱,水的KW不变
B. NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用
C. 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)
D. 常温0.1mol·L-1HA溶液中c(OH-)/ c(H+)=10-8,则0.01mol·L-1 HA溶液中c(H+)=1×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)现有反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
①如果上述反应的平衡常数K值变大,该反应___(填字母)。
a.一定向正反应方向移动 b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动过程中逆反应速率先减小后增大
②若反应容器的容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为___。
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反应向___(填“正反应”或“逆反应”)方向进行。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___。
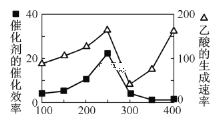
②为了提高该反应中CO2的转化率,可以采取的措施是___。(写一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察下图,回答:
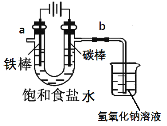
(1)电解反应的化学方程式为____________________。
(2)饱和食盐水通电后,b端产生的气体检验方法是____________。
II. 实验室用NaOH固体配制100 mL 1.0 mol·L-1的NaOH溶液,试回答下列各题:
(3)需要用托盘天平称量_______g NaOH固体;
(4)实验室有下列仪器:①漏斗 ②200mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝。若要实施溶液配制,尚缺的玻璃仪器是___________、________;
(5)容量瓶在使用前必须先____________;
(6)配制过程有以下操作: ①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀 其正确的操作顺序应是:① →_________→________ →________ →________→________→ ⑦
(7)下列五项操作中会导致所得溶液浓度偏低的有____________(填序号);
①没有洗涤烧杯内壁和玻璃棒
②未冷却到室温就将溶液转移到容量瓶并定容
③在转移过程中有溶液撒在外面
④定容时观察液面时俯视
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com