
【题目】室温下,分别向体积均为20mL、浓度均为0.1mol/L的HX、HY溶液中滴加同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。已知pOH水![]() 水(OH-),
水(OH-),![]() 水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
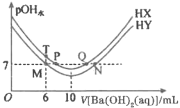
A.室温下,Ka(HX)>Ka(HY)
B.Q点溶液呈中性,溶液中c(X-)=2c(Ba2+)
C.T点溶液中阴离子浓度之和大于M点
D.室温下,水解常数Kh(Y-)=6.7×10-8
【答案】B
【解析】
A.Ba(OH)2溶液的体积为10mL时,分别与HX、HY溶液恰好反应生成BaX2、BaY2,由图可知等浓度的BaY2溶液的碱性强于BaX2溶液的,即Ka(HX)>Ka(HY),A正确;
B.曲线起点溶液呈酸性,最低点(拐点)溶液为碱性,继续滴加Ba(OH)2溶液碱性增强,Q、N点溶液为碱性,溶液中c(X-)<2c(Ba2+),B不正确;
C.T、M两点所加Ba(OH)2溶液体积均为6mL,所以两点的c(Ba2+)浓度相等,据电荷守恒:c(H+)+2c(Ba2+)=c(X-)+c(OH-)、c(H+)+2c(Ba2+)=c(Y-)+c(OH-),阴离子浓度之和即为阳离子浓度之和,M点为中性,T点为酸性,所以cM(H+)<cT(H+),显然,T点阴离子浓度之和大于M点,C正确;
D.M点为中性,据电荷守恒c(Y-)=2c(Ba2+)=![]() =
=![]() ,c(HY)=
,c(HY)=![]() =
=![]() ,Kh(Y-)=
,Kh(Y-)=![]()
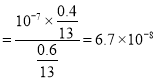 ,D正确;
,D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】现在含有生命元素硒(![]() )的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
)的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
A.硒单质在常温下是固体
B.硒的气态氢化物稳定性比![]() 强
强
C.硒是金属元素
D.硒酸(![]() )的酸性比硫酸强
)的酸性比硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:
实验序号 | Ⅰ | Ⅱ |
实验过程 | 滴加6滴(约0.3mL)0.01mol/LNa2S溶液
| 滴加6滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS) |
资料:ⅰ.![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法不正确的是( )。
A.根据实验可知,Na2S被氧化
B.取少量实验Ⅰ所得溶液进行实验,检测到有![]() ,不能说明S2-被
,不能说明S2-被![]() 氧化为
氧化为![]()
C.实验Ⅰ中生成棕褐色沉淀,说明酸性条件下S2-能将![]() 还原为MnO2
还原为MnO2
D.实验Ⅱ得到浅粉色沉淀,是由于S2-将新生成的![]() 还原为Mn2+并迅速与其结合所致
还原为Mn2+并迅速与其结合所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
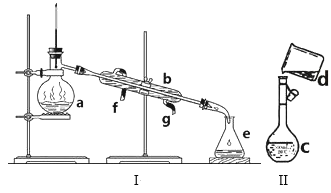
(1)写出下列仪器的名称:a.__ b.__ c.__。
(2)仪器a~e中,使用前必须检查是否漏水的有__。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__,将仪器补充完整后进行实验,温度计水银球的位置在__处。冷凝水由__(填f或g)口通入,__口流出。
(4)现需配制0.1mol/LNaOH溶液500mL,装置II是某同学转移溶液的示意图。
①图中的错误是__。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:___。
②根据计算得知,所需NaOH的质量为__g。
③配制时,正确操作顺序是(字母表示,每个字母只用一次)__。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④用“偏大”“偏小”或“无影响”填空
A.配制NaOH溶液,需称量一定质量的溶质,称量时使用了游码,但物码放置颠倒__。
B.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容__。
C.定容摇匀后,发现液面下降,继续加水至刻度线__。
D.定容时仰视刻度线__。
E.容量瓶中原有少量蒸馏水__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应,又属于氧化还原反应的是( )
A. NaOH溶液与盐酸中和B. Zn与CuSO4 溶液的反应
C. 分解氯酸钾制氧气D. MgCl2溶液 与KOH溶液产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和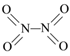 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
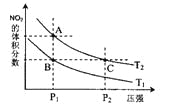
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com