
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
化学键 | | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=___________kJ/mol
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是____________________________________________。
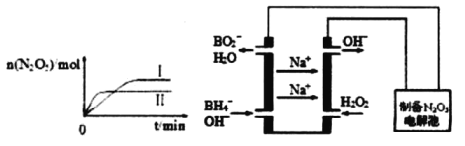
②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为______________________。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为______________________。
0.01mol/L的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II: 2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2=___________α1 (填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol![]() 含中子数为8NA
含中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为5NA
C. 足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数为NA
D. 标况下,22.4LNO和11.2LO2混合后的气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的密闭容器中,采用不同条件进行反应N2(g)+3H2(g)![]() 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(N2)=0.2mol/(Ls)B.v(NH3)=0.8mol/(Lmin)
C.v(H2)=0.3mol/(Ls)D.v(H2)=1.3mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②HCHO ③CH4 ④HCOOCH3⑤CH3CHO
A. ①② B. ③⑤ C. ①②③④⑤ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用H3R表示)可用作酸洗剂。常温下,向0.1mol·L1 H3R溶液中加入少量的NaOH固体(忽略溶液体积的变化),H3R、H2R、HR2和R3的含量与pH的关系如图所示。下列正确的是
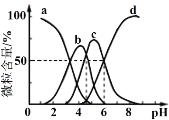
A. 图中b曲线表示HR2的变化
B. HR2的电离常数Ka3=106
C. pH=7时,c(Na+)=c(H2R)+c(HR2)+c(R3)
D. pH=5时,c(H2R)+c(HR2)+c(R3)=0.1mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列说法正确的是( )

A. 正极的电极反应式为2H++2e-===H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
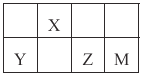
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com