
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
化学键 | | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=___________kJ/mol
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是____________________________________________。
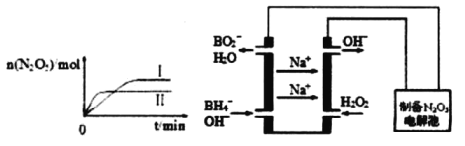
②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为______________________。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为______________________。
0.01mol/L的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II: 2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2=___________α1 (填“>”“<”或“=”)
【答案】+1268 逆反应方向的△S>0 BD BH4-+8OH--8e-=BO2-+6H2O c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+) K12/K2 75% >
【解析】
(1)根据△H=反应物键能总和-生成物键能总和=(2×946kJ·mol-1+6×2×463kJ·mol-1-4×3×391kJ·mol-1-3×496kJ·mol-1)=+1268kJ·mol-1;
(2)①根据图像,II的温度高于I,升高温度,平衡向逆反应方向进行,即该反应的正反应方向△H<0,能够自发进行,△G=△H-T△S<0,常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0;
②A、扩大容器的体积,气体压强减小,平衡向逆反应方向进行,但组分的浓度减小,混合气体颜色变浅,故A错误;
B、再充入2molNO2和1molO2,相当于增大压强,平衡向正反应方向进行,NO2的转化率增大,故B正确;
C、组分都是气体,即气体总质量不变,容器为恒容装置,气体体积不变,根据密度的定义,任何时刻,密度保持不变,因此密度不变,不能说明该反应达到平衡,故C错误;
D、该反应平衡常数增大,说明温度改变,根据①的分析,该反应为放热反应,因此该反应平衡常数增大,一定是降低温度,故D正确;
(3)BH4-中B为+3价,H为-1价,BO2-中B为|+3价,O为-2价,根据装置图,-1价H转变成+1价,根据原电池工作原理,通BH4-和OH-一极为负极,电极反应式为BH4-+8OH--8e-=BO2-+6H2O;
(4)浓度均为0.01mol·L-1,X溶液为碱性,且pH=12,推出X为NaOH,Y溶液显酸性,且pH=2,推出Y为HNO3,Z溶液显碱性,pH=8.5,推出Z为NaNO2,同理W为NH4NO3,X、Y、Z各1mol同时溶于水,NaOH和HNO3恰好完全反应,即混合溶液中的溶质为NaNO3和NaNO2,NaNO2为强碱弱酸盐,NO2-发生水解,溶液显碱性,即离子浓度大小顺序是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
(5)①K1=c(ClNO)/c2(NO2),K2=c2(ClNO)/[c(Cl2)×c2(NO)],K=[c2(NO)×c(Cl2)]/c4(NO2),因此K=K12/K2;
②10min内生成ClCNO的物质的量为7.5×10-3mol/(L·min)×2L×10min=0.15mol,则消耗NO的物质的量为0.15mol,即NO的转化率为0.15/0.2×100%=75%;该反应是气体物质的量减少,反应II在恒压条件下,压强比恒容时大,向正反应方向进行趋势大,即恒压条件下,NO的转化率α2>α1。


科目:高中化学 来源: 题型:
【题目】在固定2L密闭容器中,充入X、Y各2 mol,发生可逆反应 X(g)+2Y(g) ![]() 2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,
2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,

则Y的平衡浓度(mol / L)表示式正确的是(式中S指对应区域的面积)
A、2 – S aob B、1 – Saob
C、2 – S abdo D、1 – S bod
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用下图所示装置进行实验。以探究苯与溴发生反应的原理并分离提纯反应的产物。

请回答下列问题:
(1)写出装置Ⅱ中发生的主要化学反应方程式____________________________,其中冷凝管所起的作用为导气和________,Ⅳ中球形干燥管的作用是__________。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。Ⅲ中小试管内苯的作用是_________________________。
(3)能说明苯与液溴发生了取代反应的现象是______________________。
(4)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中以除去装置Ⅱ中残余的HBr气体。简述如何实现这一操作:______________________________________。
(5)纯净的溴苯是无色油状的液体,这个装置制得的溴苯呈红棕色,原因是里面混有______________,将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。①用蒸馏水洗涤,振荡,分液;②用__________洗涤,振荡,分液;③蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。则X、Y、Z三种金属的活动性顺序为
A. X>Y>Z B. X>Z>Y
C. Y>X>Z D. Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:

已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn | Pb | Cu | Cl | F |
质量分数% | 59.78 | 9.07 | 0.30 | 2.24 | 1.80 |
Ⅱ.浸出”时,大部分锌元素以Zn(NH3)42+形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)氨的电子式______________________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_________________________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol/L,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F-沉淀完全即溶液中c(F-)<10-5mol/L,则所加氯化钙溶液的浓度度最小为___________。已知:Ksp(CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭___________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)2Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为____________________________________________。
(6)“一次水解”时,产物为Zn(OH)xCly。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一可表示如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题。
(1)A的化学式为__________,B的化学式为__________________________________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com