
【题目】某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:

已知硝酸能将Fe2+氧化为Fe3+。回答下列问题:
(1) A可能是________________;
(2) B的化学式是______________,D的化学式是____________;
(3)滤液C中一定含有的阳离子Fe3+是____________。
【答案】溴化铁或溴化亚铁 AgBr Fe(SCN)3 Fe3+
【解析】
和硝酸银溶液发生反应生成淡黄色不溶于硝酸的沉淀是溴化银,Fe2+具有强的还原性,可以被硝酸氧化为Fe3+。Fe3+遇到硫氰酸钾显示红色。
A中加入适量酸化的AgNO3溶液,产生浅黄色沉淀B,B是AgBr,说明A中含有的阴离子是Br-,过滤后向滤液C中加入KSCN溶液,产生D呈血红色,说明D是Fe(SCN)3,C中含有Fe3+,由于向A中加入酸化的AgNO3溶液,在酸性条件下H+、NO3-具有硝酸的作用,表现为强氧化性,可以将Fe2+氧化为Fe3+,所以溶液C中含有的Fe3+可能是A中,也可能是Fe2+被氧化产生的。
(1)根据上述分析可知A是溴化铁或溴化亚铁;
(2)B是难溶于酸的AgBr;D的化学式是Fe(SCN)3;
(3)滤液C中一定含有的阳离子是Fe3+。


科目:高中化学 来源: 题型:
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l) ![]() C2H5OH(l) ΔH=-44.2kJ·mol-1
C2H5OH(l) ΔH=-44.2kJ·mol-1
2CO2(g)+2H2O(l) ![]() C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
已知2CO2(g)+3H2O(l) ![]() C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
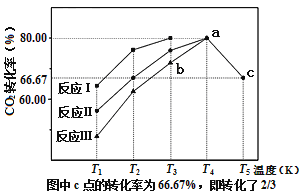
①催化剂效果最佳的反应是___(填“反应I”,“反应II”,“反应III”)。
②b点v(正)___v(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___。
④c点时该反应的平衡常数K=___。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
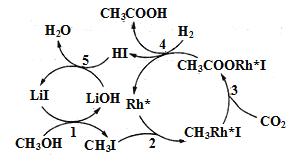
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟硼铍酸钾(KBeBF,含K、B、Be、O、F元素)。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出___种波长不同的光。
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是__。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是___。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF![]() 使酸性大大增强。HF
使酸性大大增强。HF![]() 的结构式为___;H3BO3和BF
的结构式为___;H3BO3和BF![]() 中,B原子的杂化类型分别为___、__。
中,B原子的杂化类型分别为___、__。
(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为____。

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是___。

②BeO晶胞中,O的堆积方式为____;设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的

A. 增大X或Y的浓度 B. 增大压强
C. 增大Z的浓度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NO2(g) ![]() N2O4(g),在体积相同的A和B两个带活塞的玻璃容器中,如分别注入1/4容积颜色相同的NO2和Br2(气),然后将活塞同时向外拉到1/2处(快速),过一会儿可以看到
N2O4(g),在体积相同的A和B两个带活塞的玻璃容器中,如分别注入1/4容积颜色相同的NO2和Br2(气),然后将活塞同时向外拉到1/2处(快速),过一会儿可以看到
A.A中颜色比B中浅B.A中颜色比B中深
C.A、B中颜色深浅一样D.A、B中颜色都比开始时深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用惰性电极电解下列溶液,写出电极反应式和总反应式以及溶液复原需加入的物质
①NaCl溶液
阴极:_________;阳极:_________;总反应式:_______________;溶液复原需加入的物质____________。
②CuSO4溶液
阴极:_________;阳极:______;总反应式:____________________________;溶液复原需加入的物质____________。
(2)写出下列原电池电极反应式和总反应式
①氢氧燃料电池(电解质是KOH溶液)
负极反应:______________________;
正极反应:__________________;
总反应:_____________。
②甲烷燃料电池。碱性介质(如KOH)
负极:____________;
正极:______________;
总反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列有关结论正确的是( )
A.向稀醋酸中加水稀释使电离程度增大,溶液pH减小
B.将CH3COONa溶液从20℃升温至30℃,![]() 溶液中增大
溶液中增大
C.向0.1mol·L-1的NaHSO3溶液中加入氨水至中性,则c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
D.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com