
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l) ![]() C2H5OH(l) ΔH=-44.2kJ·mol-1
C2H5OH(l) ΔH=-44.2kJ·mol-1
2CO2(g)+2H2O(l) ![]() C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
已知2CO2(g)+3H2O(l) ![]() C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
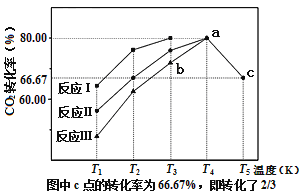
①催化剂效果最佳的反应是___(填“反应I”,“反应II”,“反应III”)。
②b点v(正)___v(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___。
④c点时该反应的平衡常数K=___。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
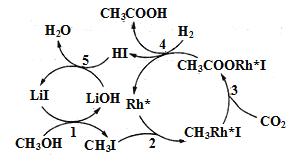
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式:___。
【答案】Ea-1366.8 CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq) v=kc(CH3CH2Cl) 反应I > 该反应为放热反应,温度升高,平衡逆向移动 ![]() CO2+6e-+6H+=CH3OH+H2O CH3OH+CO2+H2
CO2+6e-+6H+=CH3OH+H2O CH3OH+CO2+H2![]() CH3COOH+H2O
CH3COOH+H2O
【解析】
(1)应用盖斯定律,计算出2CO2(g)+3H2O(l)![]() C2H5OH(l)+3O2(g)的ΔH,并按照ΔH=正反应的活化能-逆反应的活化能,计算逆反应的活化能,氯乙烷在碱性条件下水解得到乙醇和氯化钠,据此写反应的离子方程式,按反应物浓度对速率的影响数据,写反应速率方程式即可;
C2H5OH(l)+3O2(g)的ΔH,并按照ΔH=正反应的活化能-逆反应的活化能,计算逆反应的活化能,氯乙烷在碱性条件下水解得到乙醇和氯化钠,据此写反应的离子方程式,按反应物浓度对速率的影响数据,写反应速率方程式即可;
(2)一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2后反应得到甲醇和水蒸气,反应方程式为![]() ,按照CO2的转化率随温度变化关系图分析、计算回答即可;
,按照CO2的转化率随温度变化关系图分析、计算回答即可;
(3)①原料中的CH3OH可通过电解法由CO2制取,二氧化碳在阴极反应,故是二氧化碳得电子被还原的反应,据此写生成CH3OH的电极反应式;
②根据图示,找出总的反应物、催化剂和产物,据此写总反应的化学方程式;
(1)反应①C2H4(g)+H2O(l)![]() C2H5OH(l) ΔH1=-44.2kJ·mol-1
C2H5OH(l) ΔH1=-44.2kJ·mol-1
反应②2CO2(g)+2H2O(l)![]() C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
应用盖斯定律,反应①+反应②得到:2CO2(g)+3H2O(l)![]() C2H5OH(l)+3O2(g),则该反应的ΔH=ΔH1+ΔH2,故ΔH =-44.2kJ·mol-1+(+1411.0kJ·mol-1)=+1366.8kJ·mol-1,因为ΔH=正反应的活化能-逆反应的活化能,正反应的活化能为EakJ·mol-1,则逆反应的活化能为Ea-1366.8kJ·mol-1;
C2H5OH(l)+3O2(g),则该反应的ΔH=ΔH1+ΔH2,故ΔH =-44.2kJ·mol-1+(+1411.0kJ·mol-1)=+1366.8kJ·mol-1,因为ΔH=正反应的活化能-逆反应的活化能,正反应的活化能为EakJ·mol-1,则逆反应的活化能为Ea-1366.8kJ·mol-1;
答案为:Ea-1366.8;
氯乙烷在碱性条件下水解得到乙醇和氯化钠,则反应的离子方程式为CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq);该反应的速率方程为v=kcm(CH3CH2Cl)cn(OH-),研究表明,CH3CH2Cl浓度减半,反应速率减半,则可知m=1,而OH-浓度减半对反应速率没有影响,则n=0,故反应速率方程式为v=kc(CH3CH2Cl);
答案为:CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq);v=kc(CH3CH2Cl);
(2)一定条件下,密闭容器中发生的反应为![]() ,①相同温度下相同时间内CO2转化率最高的是反应Ⅰ的图线,故最佳催化剂为反应I;
,①相同温度下相同时间内CO2转化率最高的是反应Ⅰ的图线,故最佳催化剂为反应I;
答案为:反应I;
②图线中b点未达到平衡状态,则v(正) >v(逆);
答案为:>;
③若此反应在a点时已达平衡状态,则继续升温就会使平衡移动,故a点的转化率比c点高的原因为该反应为放热反应,温度升高,平衡逆向移动;
答案为:该反应为放热反应,温度升高,平衡逆向移动;
④该条件下,一开始往2L恒容密闭容器中充入1molCO2和3molH2,由图知,c点时二氧化碳转化了![]() ,则
,则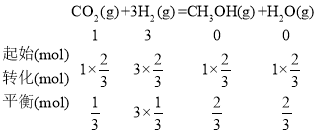 ,平衡时2L容器内
,平衡时2L容器内![]() 的浓度依次为
的浓度依次为![]() ,则该反应的平衡常数
,则该反应的平衡常数![]() =
=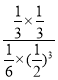 =
=![]() ;
;
答案为: ![]() ;
;
(3)①通过电解法由CO2制取CH3OH,碳元素化合价降低,故是二氧化碳得电子被还原的反应,故二氧化碳在阴极反应,则生成CH3OH的电极反应式为CO2+6e-+6H+=CH3OH+H2O;
②根据图示,CH3OH、CO2和H2在LiI、Rh+催化作用下生产CH3COOH和H2O,总反应的化学方程式为CH3OH+CO2+H2![]() CH3COOH+H2O;
CH3COOH+H2O;
答案为:CO2+6e-+6H+=CH3OH+H2O;CH3OH+CO2+H2![]() CH3COOH+H2O。
CH3COOH+H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为有机物,其中A常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。
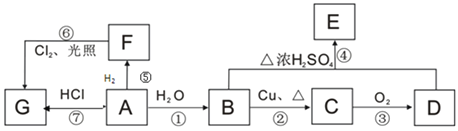
已知:![]() ,请回答下列问题:
,请回答下列问题:
(1)B、D中官能团的名称:B____________,D________________。
(2)指出下列编号对应反应的反应类型:①____________,⑥_____________。
(3)在F的同系物中最简单的有机物的空间构型为___________,电子式为____________。
(4)写出与E含有相同官能团(不含E)的所有同分异构体的结构简式:_________。
(5)写出下列编号对应反应的化学反应方程式:
②_______________________;
④______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O![]() 的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
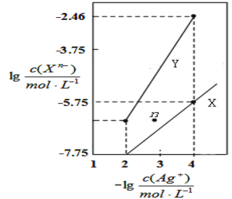
A.Ksp(Ag2C2O4)数量级为10-11
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl-)=c(C2O![]() )的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O
2AgCl(s)+C2O![]() (aq)的平衡常数为10-0.71
(aq)的平衡常数为10-0.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:

回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化如图所示,则下列说法中正确的是
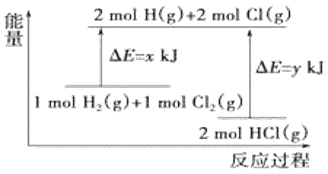
A.该反应是吸热反应
B.断裂1molH-H键和1molCl-Cl键时能放出x kJ的能量
C.断裂2molH-Cl键时需要吸收y kJ的能量
D.2molHCl(g)的总能量高于1molH2(g)和1molCl2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:

已知硝酸能将Fe2+氧化为Fe3+。回答下列问题:
(1) A可能是________________;
(2) B的化学式是______________,D的化学式是____________;
(3)滤液C中一定含有的阳离子Fe3+是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com