
【题目】新型冠状病毒“COVID-19”疫情期间,越来越多的人意识到学习化学的重要性。下列说法正确的是.
A.洗手所用的肥皂可通过油脂的皂化反应制得
B.灭活“COVID-19”的医用酒精其质量分数为75%
C.公共场所用“84”消毒液消毒,该消毒液的有效成分是次氯酸钙
D.N95口罩使用的熔喷布主要成分为聚丙烯,聚丙烯属于纯净物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】36.5g氯化氢溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A. 所得溶液的物质的量浓度为1mol·L-1B. 36.5g氯化氢含有NA个原子
C. 36.5gHCl气体占有的体积约为22.4LD. 所得溶液的质量分数w=36.5c/1000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C. 由300~400℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D. 根据图象推测,工业上制备乙酸最适宜的温度应为250℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是用途广泛的铜盐产品。CuCl晶体呈白色,微溶于水,不溶于乙醇和稀盐酸,溶于浓盐酸,见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl晶体,设计如下制备流程:

实验涉及的操作及装置如下:

已知
①在较浓的盐酸溶液中:
a.Cu2+主要以[CuCl4]2-(呈黄色)形式存在
b.Fe3+能溶解于萃取剂一甲基异丁基甲酮(无色透明液体,密度为0.8g/cm3)
②CuCl在溶液中存在络合与解离平衡:CuCl(s)+3Cl-(aq)![]() [CuCl4]3-(aq无色)
[CuCl4]3-(aq无色)
③SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成SO2和HCl气体
请回答:
(1)下列有关CuCl2提纯操作正确的是______
A.将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,用力振摇(见上图1)
B.经几次振摇并打开上口玻璃塞放气后,将分液漏斗置于铁架台的铁圈上,静置片刻
C.Fe2+经氧化、萃取、分液,进入有机相除去
D.取分液后的水相少许,滴入KSCN溶液检验萃取是否完全
(2)还原反应装置如上图2所示:
①向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞_____(填“a”、“b”或“a和b”)。
②水相中[CuCl4]2-被SOCl2还原为[CuCl4]3-的离子方程式为______。
③判断反应完成的实验现象是________________。
(3)向混合液中加入大量去氧水能得到CuC1悬浊液的原因是___________
(4)“系列操作”包括:抽滤→洗涤→干燥。下列说法不正确的是__________
A.抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等
B.可选用无水乙醇洗涤CuCl,洗涤时应关闭水龙头,使洗涤剂缓慢通过沉淀物
C.取最后一次洗涤液,滴加BaCl2溶液,若无白色沉淀产生,则证明产品已洗净
D.在避光下产品应置于A处真空干燥(上图3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃X在标況下的密度1.25g/L,液态烃A摩尔质量为106g/mol,C是油脂皂化反应后的产物之一,具吸水保湿功能,D是有芳香气味的酯。它们之间的转化如下图所示(含有相同官能团的有机物通常具有相似的化学性质)
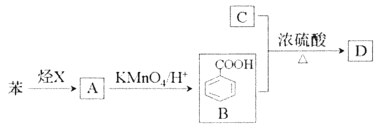
请回答
(1)烃X所含官能团的名称是_______。
(2)A→B的反应类型是_________。
(3)B与C按3:1反应生成D的化学方程式为_______。
(4)下列说法正确的是_______。
A.邻二溴苯只有一种结构,证明苯环结构中不存在单双键交替结构
B.上述六种有机物都能与H2发生加成反应
C.可用新制Cu(OH)2鉴别B、C、D
D.相同质量的苯与苯甲酸充分燃烧消耗等量的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________,氧化产物是______。
(3)“碱浸”时生成CO2的电子式为_______,碱浸”时含钼化合物发生的主要反应的离子方程式为_____。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为______。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO42-的质量分数为_____%。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)B装置作用____。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_____。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质正确的是___(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为___(填化学式)
(4)F装置的作用是(用化学方程式表示)____。
(5)为测定(3)中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_____,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_____(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____。
②温度升高,副反应更容易发生的主要原因是__________________________________。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。

①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为______。
②298 K 时,该工艺总反应的热化学方程式为_____________________________________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com