
【题目】氯化亚铜是用途广泛的铜盐产品。CuCl晶体呈白色,微溶于水,不溶于乙醇和稀盐酸,溶于浓盐酸,见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl晶体,设计如下制备流程:

实验涉及的操作及装置如下:

已知
①在较浓的盐酸溶液中:
a.Cu2+主要以[CuCl4]2-(呈黄色)形式存在
b.Fe3+能溶解于萃取剂一甲基异丁基甲酮(无色透明液体,密度为0.8g/cm3)
②CuCl在溶液中存在络合与解离平衡:CuCl(s)+3Cl-(aq)![]() [CuCl4]3-(aq无色)
[CuCl4]3-(aq无色)
③SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成SO2和HCl气体
请回答:
(1)下列有关CuCl2提纯操作正确的是______
A.将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,用力振摇(见上图1)
B.经几次振摇并打开上口玻璃塞放气后,将分液漏斗置于铁架台的铁圈上,静置片刻
C.Fe2+经氧化、萃取、分液,进入有机相除去
D.取分液后的水相少许,滴入KSCN溶液检验萃取是否完全
(2)还原反应装置如上图2所示:
①向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞_____(填“a”、“b”或“a和b”)。
②水相中[CuCl4]2-被SOCl2还原为[CuCl4]3-的离子方程式为______。
③判断反应完成的实验现象是________________。
(3)向混合液中加入大量去氧水能得到CuC1悬浊液的原因是___________
(4)“系列操作”包括:抽滤→洗涤→干燥。下列说法不正确的是__________
A.抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等
B.可选用无水乙醇洗涤CuCl,洗涤时应关闭水龙头,使洗涤剂缓慢通过沉淀物
C.取最后一次洗涤液,滴加BaCl2溶液,若无白色沉淀产生,则证明产品已洗净
D.在避光下产品应置于A处真空干燥(上图3)
【答案】CD b 2[CuCl4]2-+SOCl2+3H2O=2[CuCl4]3-+SO42-+6H++2Cl- 溶液由黄色变为无色 加水使平衡CuCl(s)+3Cl-![]() [CuCl4]3-(aq)逆向移动,生成CuCl沉淀 AB
[CuCl4]3-(aq)逆向移动,生成CuCl沉淀 AB
【解析】
(1) A.萃取、分液时应使液体充分接触,将分液漏斗倒转过来,用力振摇;
B.萃取分液后要将分液漏斗置于铁架台的铁圈上,待液体分层
C.Fe2+经氧化变为Fe3+,萃取、分液,进入有机相除去;
D.根据Fe3+遇SCN-会变为红色检验萃取是否完全;
(2)①滴液漏斗液面上下气体压强一致,打开下面活塞,液体可顺利滴下;
②[CuCl4]2-与SOCl2在H2O中发生氧化还原反应,生成[CuCl4]3-、硫酸和HCl,根据电子、原子及电荷守恒书写离子方程式;
③根据[CuCl4]2-及[CuCl4]3-的颜色不同判断反应是否完全;
(3)从平衡移动角度分析原因;
(4)从分离操作使用仪器分析、物质的溶解性确定使用的洗涤试剂、物质颜色的判断是否洗涤干净、根据物质性质及仪器的作用判断保存方法。
(1) A.萃取、分液时为了使液体充分接触,应将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,然后将分液漏斗倒转过来,用力振摇,A错误;
B.萃取分液后要将分液漏斗置于铁架台的铁圈上,待液体充分分层,不是静置片刻,B错误;
C.Fe2+经氧化变为Fe3+,加入萃取剂一甲基异丁基甲酮进行萃取,然后分液,使Fe3+进入有机相而除去,C正确;
D.由于Fe3+遇SCN-溶液会变为血红色,所以取分液后的水相少许,滴入KSCN溶液检验,若溶液不变为红色,就证明萃取完全,D正确;
故合理选项是CD;
(2)①由于SOCl2在滴液漏斗中,滴液漏斗液体上下气体压强一致,打开下部活塞b,液体就可以在重力作用下顺利滴到三颈烧瓶中,不需要再打开上口a活塞,所以答案为需打开活塞b;
②水相中[CuCl4]2-与SOCl2及水反应生成[CuCl4]3-、硫酸及HCl,反应的离子方程式为2[CuCl4]2-+SOCl2+3H2O=2[CuCl4]3-+SO42-+6H++2Cl-;
③由于[CuCl4]2-显黄色,反应后生成的[CuCl4]3-显无色,所以若溶液由黄色变为无色,就证明反应完成;
(3)向混合液中加入大量去氧水能得到CuC1悬浊液,是由于加水能离子浓度降低,使可逆反应CuCl(s)+3Cl-![]() [CuCl4]3-(aq) 的平衡逆向移动,从而生成更多CuCl沉淀;
[CuCl4]3-(aq) 的平衡逆向移动,从而生成更多CuCl沉淀;
(4) A.进行抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等,A正确;
B.由于CuCl微溶于水,不溶于乙醇,所以可选用无水乙醇洗涤CuCl,B正确;
C.由于CuCl是白色微溶于水的物质,BaSO4也是白色难溶性的物质,所以不能用滴加BaCl2溶液,根据是否有白色沉淀产生证明产品是否洗净,C错误;
D.干燥器是干燥物质的,不能用于保存物质,D错误;
故合理选项是AB。


科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
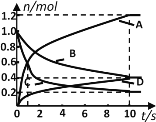
A. 反应进行到1s时,v (A)=v (C)
B. 反应进行到10s时,各物质的反应速率相等
C. 反应进行到10s时,A的平均反应速率为0.06 mol/(L·s)
D. 该反应的化学方程式为6A+3B![]() 4C+2D
4C+2D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于基本营养物质的叙述中,错误的是
A. 葡萄糖和果糖的分子式完全相同,它们互为同分异构体
B. 油脂在酸性条件下可以水解为甘油和高级脂肪酸,该反应称为皂化反应
C. 常温条件下,淀粉遇碘即可变蓝,该反应是淀粉的特征反应
D. 酶是一类特殊的蛋白质,是生物体内重要的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是

A. 原溶液中一定含有SO42-离子 B. 原溶液中一定含有NH4+离子
C. 原溶液中一定含有Cl-离子 D. 原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒“COVID-19”疫情期间,越来越多的人意识到学习化学的重要性。下列说法正确的是.
A.洗手所用的肥皂可通过油脂的皂化反应制得
B.灭活“COVID-19”的医用酒精其质量分数为75%
C.公共场所用“84”消毒液消毒,该消毒液的有效成分是次氯酸钙
D.N95口罩使用的熔喷布主要成分为聚丙烯,聚丙烯属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某氖原子的质量ag,12C原子的质量是bg,NA表示阿伏加德罗常数,下列说法不正确的是( )
A.该氖原子的相对原子质量是12a/bB.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量是W/(aNA)molD.Wg该氖原子所含质子数为10W/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是( )

A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe →Fe2++2e-
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两个反应所属反应类型相同的是( )
A. 甲烷和氯气在光照下反应;乙烯能使溴水褪色
B. 乙烷在氧气中燃烧;由乙烯制取聚乙烯
C. 乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色
D. 乙烯和水反应制乙醇;乙烯能使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com