
【题目】下列关于基本营养物质的叙述中,错误的是
A. 葡萄糖和果糖的分子式完全相同,它们互为同分异构体
B. 油脂在酸性条件下可以水解为甘油和高级脂肪酸,该反应称为皂化反应
C. 常温条件下,淀粉遇碘即可变蓝,该反应是淀粉的特征反应
D. 酶是一类特殊的蛋白质,是生物体内重要的催化剂
科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境,必须进行处理。某工厂的处理工艺流程如下:
![]()
(1)N2H4的电子式为___________。
(2)下列溶液中,可以代替上述流程中N2H4的是___________。(填选项序号)
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O72-和CrO42-相互转化的平衡,请用离子方程式表示它们之间的转化反应___________;
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为____________写化学式)。
(5)工业上可用电解法来处理含Cr2O![]() 的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O
的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O![]() 还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。
还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是________(填“铁”或“石墨”)。
②上述处理过程中,Cr2O![]() 被还原成Cr3+的离子方程式为_______________________。
被还原成Cr3+的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) △H=-92kJ/mol,下列说法一定正确的是
2Z(g) △H=-92kJ/mol,下列说法一定正确的是
A. 混合气体的密度不随时间发生变化说明反应达到平衡状态
B. 充入氩气使压强增大,v正、v逆均増大
C. 反应达平衡时放出的热量小于92kJ
D. 反应达平衡状态时:2 v正(X)=v逆(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C. 由300~400℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D. 根据图象推测,工业上制备乙酸最适宜的温度应为250℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,当X和Y按1:1的物质的量之比混合并通入密闭容器进行反应:X+2Y![]() 2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时X的转化率是
2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时X的转化率是
A. 70% B. 60% C. 50% D. 40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是用途广泛的铜盐产品。CuCl晶体呈白色,微溶于水,不溶于乙醇和稀盐酸,溶于浓盐酸,见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl晶体,设计如下制备流程:

实验涉及的操作及装置如下:

已知
①在较浓的盐酸溶液中:
a.Cu2+主要以[CuCl4]2-(呈黄色)形式存在
b.Fe3+能溶解于萃取剂一甲基异丁基甲酮(无色透明液体,密度为0.8g/cm3)
②CuCl在溶液中存在络合与解离平衡:CuCl(s)+3Cl-(aq)![]() [CuCl4]3-(aq无色)
[CuCl4]3-(aq无色)
③SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成SO2和HCl气体
请回答:
(1)下列有关CuCl2提纯操作正确的是______
A.将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,用力振摇(见上图1)
B.经几次振摇并打开上口玻璃塞放气后,将分液漏斗置于铁架台的铁圈上,静置片刻
C.Fe2+经氧化、萃取、分液,进入有机相除去
D.取分液后的水相少许,滴入KSCN溶液检验萃取是否完全
(2)还原反应装置如上图2所示:
①向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞_____(填“a”、“b”或“a和b”)。
②水相中[CuCl4]2-被SOCl2还原为[CuCl4]3-的离子方程式为______。
③判断反应完成的实验现象是________________。
(3)向混合液中加入大量去氧水能得到CuC1悬浊液的原因是___________
(4)“系列操作”包括:抽滤→洗涤→干燥。下列说法不正确的是__________
A.抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等
B.可选用无水乙醇洗涤CuCl,洗涤时应关闭水龙头,使洗涤剂缓慢通过沉淀物
C.取最后一次洗涤液,滴加BaCl2溶液,若无白色沉淀产生,则证明产品已洗净
D.在避光下产品应置于A处真空干燥(上图3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________,氧化产物是______。
(3)“碱浸”时生成CO2的电子式为_______,碱浸”时含钼化合物发生的主要反应的离子方程式为_____。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为______。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO42-的质量分数为_____%。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷是一种有效、安全的固体储氢材料.氨硼烷的结构和乙烷相似,如图.
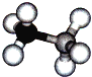
(1)氨硼烷的晶体类型为__.
(2)氮和硼比较,电负性大的元素为__(填元素符号).
(3)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为__和__.
(4)氨硼烷__(填“能”或“不能”)溶于水,其原因是__.
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
该配合物中镍离子的基态电子排布式为__.该配合物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com