
| A、若X为非气态,则正反应为吸热反应 |
| B、正反应为放热反应,X一定为气态 |
| C、正反应为放热反应,X可能是气态、液态或固态 |
| D、若加入少量的Z,该平衡向左移动 |


科目:高中化学 来源: 题型:
| A、碘水和苯加入分液漏斗后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡,并不时地放气 |
| B、静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) |
| C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出,及时关闭活塞 |
| D、最后继续打开活塞,另用烧杯在分液漏斗的下口承接并保存上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X=Y |
| B、Y=10-4 X |
| C、X=10-4 Y |
| D、X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制的氯水在光照下颜色变浅 |
| B、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| C、H2、I2、HI平衡混合气加压后颜色变深 |
| D、在合成氨的反应中,加压有利于氨的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
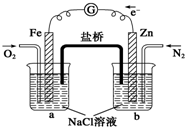
| A、烧杯a中的溶液pH不变 |
| B、烧杯a中发生氧化反应 |
| C、烧杯b中发生的反应为Zn-2e-=Zn2+ |
| D、烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原剂是HCl,氧化剂是MnO2 |
| B、每生成1 molCl2,转移电子的物质的量为2 mol |
| C、每消耗1 molMnO2,起还原剂作用的HCl消耗4mol |
| D、生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、1L0.5mol/L的HCl溶液中HCl分子数为0.5NA |
| C、常温常压下,32g氧气所含的氧原子数为2NA |
| D、18g NH4+所含的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com