
| A、增大物质的量浓度 |
| B、增大压强 |
| C、升高温度 |
| D、使用催化剂 |
科目:高中化学 来源: 题型:
| A、100ml |
| B、25ml |
| C、50ml |
| D、由于Mg、MgO的质量未知无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界中金属元素比非金属元素多 |
| B、金属单质一般属于金属晶体 |
| C、导电、导热、延展性好、高熔点是金属的通性 |
| D、金属原子一般叫容易失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X为非气态,则正反应为吸热反应 |
| B、正反应为放热反应,X一定为气态 |
| C、正反应为放热反应,X可能是气态、液态或固态 |
| D、若加入少量的Z,该平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
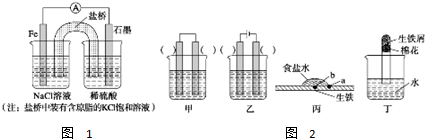
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+3 | B、+2 | C、+1 | D、0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、H2C2O4在反应中被氧化 |
| B、KClO3在反应中得到电子 |
| C、CO2是还原产物 |
| D、4 molKClO3参加反应有8 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 |
| B、某主族元素X的气态基态原子的逐级电离能分别是578、1817、2745、11575、14830、18376(kJ?mol-1)…,它与氯气反应所生成的物质的化学式为XCl2 |
| C、元素周期表中,处于非金属三角区边界的锗的电负性为1.8,则可以推测电负性为4.0的元素为非金属元素 |
| D、因为Be和Al的电负性都是1.5,所以处于周期表对角线位置的Be和Al的某些性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 编号 | 物质转化关系 | A | D | E |
| ① | 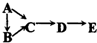 | Si | SiO2 | H2SiO3 |
| ② | N | NO2 | HNO3 | |
| ③ | S | SO2 | H2SO4 | |
| ④ | Na | Na2O2 | NaOH |
| A、①②③④ | B、②③ |
| C、①③④ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com