
| A、③⑤ | B、②④ | C、④⑤ | D、①③ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
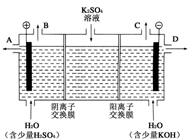 电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
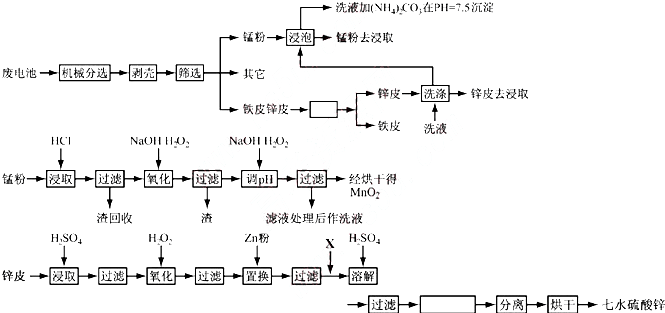
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当NH3、O2、NO、H2O浓度比为4:5:4:6时达到平衡 | ||
B、平衡时v正(O2)=
| ||
| C、平衡后减小压强,混合气体平均摩尔质量增大 | ||
| D、平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| M |
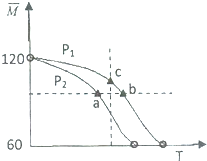
. |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
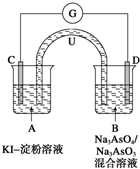
查看答案和解析>>
科目:高中化学 来源: 题型:
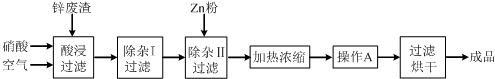
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
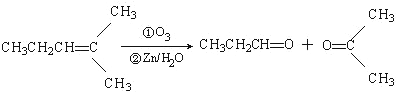
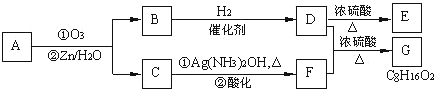
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中及时将NH3液化分离,可加快反应速率,并提高N2、H2的转化率 |
| B、向汽油中添加甲醇后,该混合燃料的热值不变 |
| C、氯碱工业中采用阴离子交换膜法,可防止阴极产生的Cl2和阳极产生的碱反应 |
| D、目前淡化海水的方法有多种,其中蒸馏法历时最久,成本最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com