
| A、当NH3、O2、NO、H2O浓度比为4:5:4:6时达到平衡 | ||
B、平衡时v正(O2)=
| ||
| C、平衡后减小压强,混合气体平均摩尔质量增大 | ||
| D、平衡后升高温度,混合气体中NO含量降低 |
| 5 |
| 4 |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0℃、101 kPa条件下,某气体的体积为22.4 L,则该气体的物质的量约为1 mol |
| B、1 mol某气体体积为22.4 L,则该气体所处状态一定为标准状况 |
| C、标准状况下,1 mol H2O的体积为22.4 L |
| D、1 mol CO2在25℃和101KPa时,体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
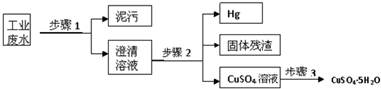
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤ | B、②④ | C、④⑤ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
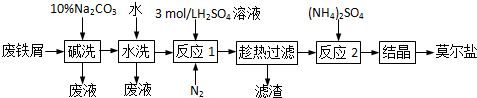
| 4.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com