
| A、在0℃、101 kPa条件下,某气体的体积为22.4 L,则该气体的物质的量约为1 mol |
| B、1 mol某气体体积为22.4 L,则该气体所处状态一定为标准状况 |
| C、标准状况下,1 mol H2O的体积为22.4 L |
| D、1 mol CO2在25℃和101KPa时,体积约为22.4L |
| V |
| Vm |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
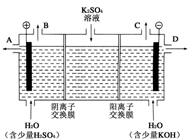 电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,水电离出的c(H+)=1×10-12mol/L,某无色溶液中不可能大量存在:Al3+、NH4+、Cl-、S2- |
| B、pH=2的溶液中,可能大量存在:Na+、Fe2+、ClO-、SO42- |
| C、常温下某溶液中KW/c(H+)=1×10-12,溶液中可能大量存在:Na+、NH4+、Cl-、HCO3- |
| D、某溶液中加入少量Al 有气体生成,溶液中可能大量存在:Na+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
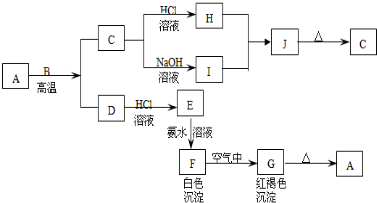
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
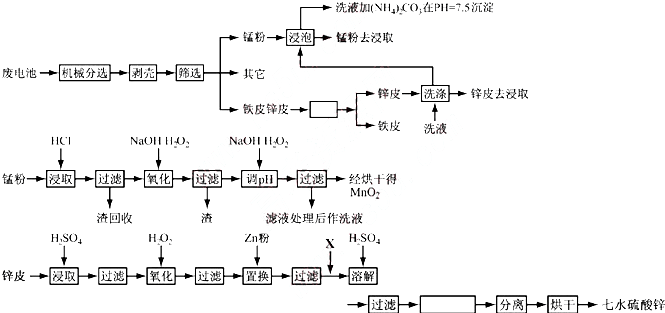
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当NH3、O2、NO、H2O浓度比为4:5:4:6时达到平衡 | ||
B、平衡时v正(O2)=
| ||
| C、平衡后减小压强,混合气体平均摩尔质量增大 | ||
| D、平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
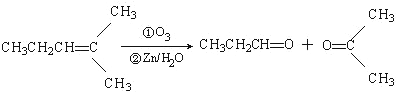
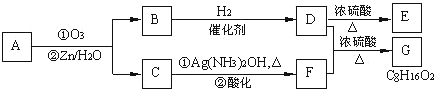
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com