
| A、3.2 g |
| B、2.4 g |
| C、1.6 g |
| D、0.8 g |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
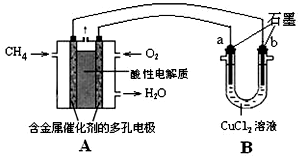
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- |
| B、将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ |
| C、待检液逐滴加入NaOH溶液,有白色胶状沉淀产生后来沉淀逐渐消失,则原溶液中可能含有Al3+ |
| D、待检液中先加入KSCN溶液,无明显现象,再加入氯水溶液显血红色,则待检液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的Na2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中通入过量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
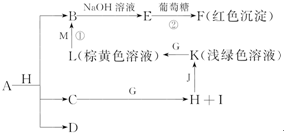
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4+2O2
| ||
| B、CH2═CH2+Br2→CH2Br-CH2Br | ||
| C、CH4+Cl2→CH3Cl+HCl | ||
| D、2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
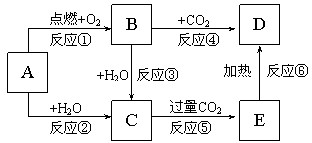 如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
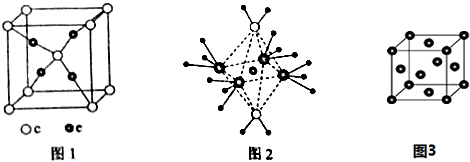
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com