
| 0.1mol |
| 2 |
| 1.1��10 -10 |
| 1.0��10 -3 |
| 3.2��10 -7 |
| 1.1��10 -7 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaCl��CuSO4��Ba��NO3��2 |
| B��AlCl3��NaOH��KNO3 |
| C��K2CO3��HNO3��HCl |
| D��Na2S��HCl��KCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ɫ��ͨ�����ڷ���ṹ������������ʺͻ�ѧ�������Ƶ����ʣ�����ɫ����������һ�� |
| B��������ɺ���Ҫϴ�ӳ�������������©����ֱ�Ӽ�ϴ�Ӽ���Ȼ��ˮ��ͷ��ʹϴ�Ӽ�Ѹ��ͨ������ |
| C����ȡ�����е�Ԫ��ʱ��Ϊ��֤I-��ȫ������ΪI2����ü����������������H2O2��������ˮ�� |
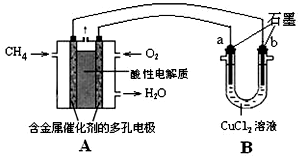
| D��������δ��ȥ����Ĥ����Ƭ�ֱ�Ͷ��1mol?L-1CuSO4��Һ��1mol?L-1CuCl2��Һ�У�����Ƭ�̣���Ƭ���涼�۲첻�����Եķ�Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �Իش��������⣺
�Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
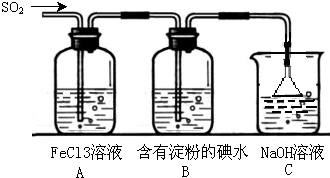 ij��ȤС��̽��SO2���廹ԭFe3+��I2������ʹ�õ�ҩƷ��װ����ͼ��ʾ��
ij��ȤС��̽��SO2���廹ԭFe3+��I2������ʹ�õ�ҩƷ��װ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | �� | �� | �� |
| ��ʼͶ���� | 2mol SO2��1mol O2 | 2mol SO3 | 2mol SO2��2mol O2 |
| ��Ӧ�ų������յ� ������kJ�� | Q1 | Q2 | Q3 |
| ƽ��ʱSO3�����ʵ��� | n1 | n2 | n3 |
| ƽ��ת���� | |||
| ƽ��ʱѹǿ | p1 | p2 | p3 |
| A��Q1=Q2��Q3 |
| B��n2��n1��n3 |
| C��a1+a2=1 |
| D��p1��p2��p3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3.2 g |
| B��2.4 g |
| C��1.6 g |
| D��0.8 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com