
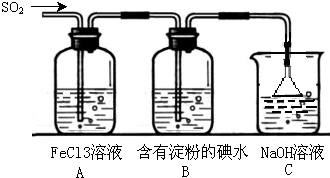
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
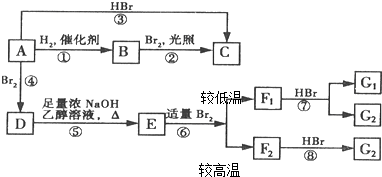
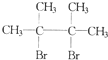 F1和F2为同分异构体,G1和G2互为同分异构体)
F1和F2为同分异构体,G1和G2互为同分异构体)| 浓NaOH、乙醇溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
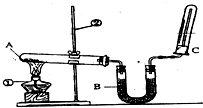 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从溴水中提取溴--分液 |
| B、分离水和汽油的混合物--蒸馏 |
| C、从硝酸钾和氯化钾混合液中获取硝酸钾--蒸发 |
| D、分离饱和食盐水和沙子的混合物--过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
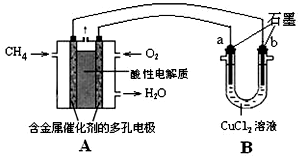
查看答案和解析>>
科目:高中化学 来源: 题型:
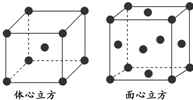
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向CuSO4溶液中加入适量铁粉 |
| B、等物质的量浓度、等体积的Na2SO4与BaCl2溶液 |
| C、等物质的量的NaHCO3与Na2O2固体 |
| D、在NaBr溶液中通入过量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com