
 ��
�� �����Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶r��S2-����r��Cl-����r��K+����r��Ca2+����
�����Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶r��S2-����r��Cl-����r��K+����r��Ca2+���� ��
�� ��r��S2-����r��Cl-����r��K+����r��Ca2+����
��r��S2-����r��Cl-����r��K+����r��Ca2+����

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
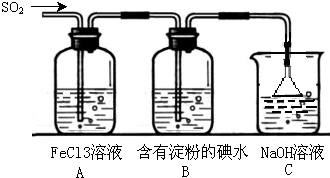 ij��ȤС��̽��SO2���廹ԭFe3+��I2������ʹ�õ�ҩƷ��װ����ͼ��ʾ��
ij��ȤС��̽��SO2���廹ԭFe3+��I2������ʹ�õ�ҩƷ��װ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��ȡ����Ӧ | B���ӳɷ�Ӧ |
| C���ۺϷ�Ӧ | D��������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
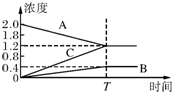 ��ͼ��������800��ʱ��A��B��C�����������ʵ�Ũ����ʱ��仯�������t��ƽ���ʱ�䣬���Դ����߱�ʾ�ķ�Ӧ�ǣ�������
��ͼ��������800��ʱ��A��B��C�����������ʵ�Ũ����ʱ��仯�������t��ƽ���ʱ�䣬���Դ����߱�ʾ�ķ�Ӧ�ǣ�������| A��2A?B+3C |
| B��B+3C?2A |
| C��A+C?B |
| D��B?A+C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ԣ�H2��=0.15 mol/��L?min�� |
| B���ԣ�N2��=0.2mol/��L?min�� |
| C���ԣ�N2��=0.1 mol/��L?min�� |
| D���� ��NH3��=0.2mol/��L?min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2H2+O2=2H2O |
| B��SO3+H2O=H2SO4 |
| C��2F2+2H2O=4HF+O2 |
| D��2Na+2H2O=2NaOH+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2Na2O2+2H2O=4NaOH+O2�� ��Ӧ�У�Na2O2����������H2O�ǻ�ԭ�� |
| B��CaH2+2H2O=Ca��OH��2+2H2�� ��Ӧ�У�Ca��OH��2�Ȳ�����������Ҳ���ǻ�ԭ���� |
| C��KClO3+6HCl=KCl+3Cl2��+3H2O ��Ӧ�У�ת�Ƶĵ�����Ϊ6e- |
| D��KClO3+6HCl=KCl+3Cl2��+3H2O ��Ӧ�У�����������Ԫ���뱻��ԭ����Ԫ��������Ϊ6��1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com