
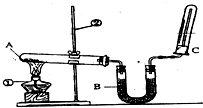
 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
| ||
| ||


科目:高中化学 来源: 题型:
| A、某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×l0-8.60 |
| B、Ka( HCN)<Ka( CH3COOH).说明同浓度时氢氰酸的酸性比醋酸强 |
| C、Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀 |
| D、Ksp( AgBr)<Ksp( AgCl),说明AgBr和AgCl均不溶于稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、前者大 | B、前者小 |
| C、相等 | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、色谱法通常用于分离结构相近、物理性质和化学性质相似的物质,气相色谱法就是其中一种 |
| B、抽滤完成后若要洗涤沉淀,可以向布氏漏斗中直接加洗涤剂,然后开大水龙头,使洗涤剂迅速通过沉淀 |
| C、提取海带中碘元素时,为保证I-完全被氧化为I2,最好加入过量的氧化剂(H2O2或新制氯水) |
| D、将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,静置片刻,铝片表面都观察不到明显的反应现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用光照的方法鉴别硫酸铜溶液和氢氧化铁胶体 |
| B、用稀硫酸来鉴别BaCl2、NaCl、Na2CO3三种溶液 |
| C、用BaCl2溶液和稀硝酸来鉴别Na2SO4和AgNO3两种溶液 |
| D、用CCl4来鉴别FeCl3溶液和碘水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 试回答下列问题:
试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
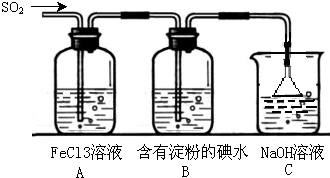 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 起始投入量 | 2mol SO2和1mol O2 | 2mol SO3 | 2mol SO2和2mol O2 |
| 反应放出或吸收的 热量(kJ) | Q1 | Q2 | Q3 |
| 平衡时SO3的物质的量 | n1 | n2 | n3 |
| 平衡转化率 | |||
| 平衡时压强 | p1 | p2 | p3 |
| A、Q1=Q2>Q3 |
| B、n2>n1>n3 |
| C、a1+a2=1 |
| D、p1>p2>p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
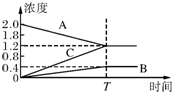 如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )
如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )| A、2A?B+3C |
| B、B+3C?2A |
| C、A+C?B |
| D、B?A+C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com