
| A、某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×l0-8.60 |
| B、Ka( HCN)<Ka( CH3COOH).说明同浓度时氢氰酸的酸性比醋酸强 |
| C、Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀 |
| D、Ksp( AgBr)<Ksp( AgCl),说明AgBr和AgCl均不溶于稀硝酸 |
| c(HSO3-)c(H+) |
| c(H2SO3) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高正价和最低负价的代数和为6 |
| Y | Y元素的第一电离能比同周期中相邻两元素的高 |
| Z | 工业上在冰晶石存在下,用电解法冶炼其单质 |
| W | 通常情况下,W和Y组成的气态化合物的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
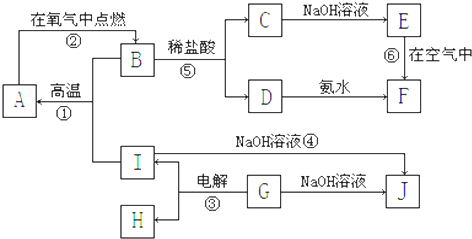
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
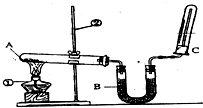 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com