
| A、NaCl、CuSO4、Ba(NO3)2 |
| B、AlCl3、NaOH、KNO3 |
| C、K2CO3、HNO3、HCl |
| D、Na2S、HCl、KCl |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高正价和最低负价的代数和为6 |
| Y | Y元素的第一电离能比同周期中相邻两元素的高 |
| Z | 工业上在冰晶石存在下,用电解法冶炼其单质 |
| W | 通常情况下,W和Y组成的气态化合物的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
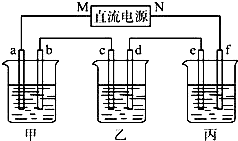 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
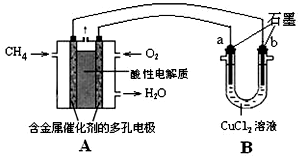
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com