
| A. | 硫酸 硫酸铜 纯碱 干冰 | B. | 硝酸 硝酸银 熟石灰 干冰 | ||
| C. | 碳酸 纯碱 食盐 冰 | D. | 醋酸 食盐 烧碱 铜 |
分析 电离出的阳离子全部是氢离子的化合物为酸;
电离出的阴离子全部是氢氧根的化合物为碱;
电离出的阴离子是酸根离子、阳离子是金属离子或铵根离子的化合物为盐;
在水溶液中和熔融状态下均不能导电的化合物为非电解质,据此分析.
解答 解:A、纯碱是碳酸钠,是盐不是碱,故A错误;
B、硝酸是酸;硝酸银为盐;熟石灰是氢氧化钙,是碱;干冰是二氧化碳,是非电解质,故B正确;
C、食盐是主要成分是氯化钠的混合物,不是盐;冰是固态的水,是电解质,故C错误;
D、铜是单质,既不是电解质也不是非电解质,故D错误.
故选B.
点评 本题考查了电解质、非电解质、酸、碱、盐的概念,难度不大,应注意的是单质和混合物既不是电解质也不是非电解质.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 将容器体积变为原来一半 | B. | 压强变为原来一半 | ||
| C. | 加入2n molCO,2n molH2O | D. | 加入2n molCO2和2n molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 要 求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Fe3+、Na+、NO3-、ClO- | 溶液pH=1 |
| C | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| D | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
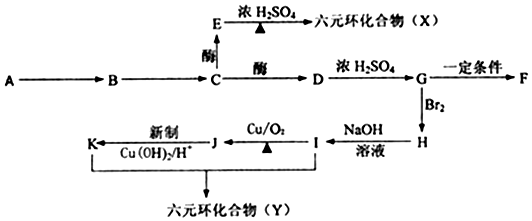
 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g镁在足量的O2中燃烧,转移的电子数为0.1 NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2 NA | |
| C. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| D. | 常温常压下,8 g O3中含有8 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com