
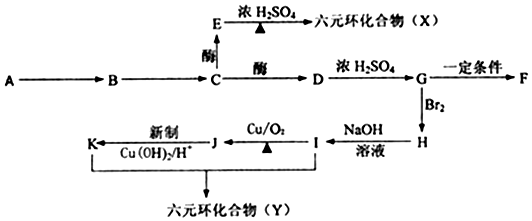
 +(2n-1)H2O.
+(2n-1)H2O.分析 天然有机物A与碘水变蓝,则A是淀粉,在酶作用下水解生成B,1molB水解可生成2molC,B是麦芽糖、C是葡萄糖;C反应生成D,D生成G,G能和溴反应生成H,H能和氢氧化钠水溶液发生取代反应,则G为烯烃,D为醇,I为醇、K羧酸,I和K生成六元环化合物,则I为HOCH2CH2OH、J为OHCCHO、K为HOOCCOOH、Y为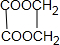 ,H为BrCH2CH2Br、G为CH2=CH2、D为CH3CH2OH,将F中的氢元素去掉可得到一种碳纤维材料,则F为HC≡CH;
,H为BrCH2CH2Br、G为CH2=CH2、D为CH3CH2OH,将F中的氢元素去掉可得到一种碳纤维材料,则F为HC≡CH;
E的核磁共振氢谱为3:1:1:1,E自身能生成六元环化合物X,E中含有羧基和醇羟基,其结构简式为CH3CH(OH)COOH,X结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:天然有机物A与碘水变蓝,则A是淀粉,在酶作用下水解生成B,1molB水解可生成2molC,B是麦芽糖、C是葡萄糖;C反应生成D,D生成G,G能和溴反应生成H,H能和氢氧化钠水溶液发生取代反应,则G为烯烃,D为醇,I为醇、K羧酸,I和K生成六元环化合物,则I为HOCH2CH2OH、J为OHCCHO、K为HOOCCOOH、Y为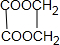 ,H为BrCH2CH2Br、G为CH2=CH2、D为CH3CH2OH,将F中的氢元素去掉可得到一种碳纤维材料,则F为HC≡CH;
,H为BrCH2CH2Br、G为CH2=CH2、D为CH3CH2OH,将F中的氢元素去掉可得到一种碳纤维材料,则F为HC≡CH;
E的核磁共振氢谱为3:1:1:1,E自身能生成六元环化合物X,E中含有羧基和醇羟基,其结构简式为CH3CH(OH)COOH,X结构简式为 ,
,
(1)B的名称是麦芽糖,故答案为:麦芽糖;
(2)E为CH3CH(OH)COOH,E中的官能团为羧基和醇羟基,故答案为:羧基和醇羟基;
(3)I为HOCH2CH2OH、H为BrCH2CH2Br,H发生取代反应生成I,H→I的化学方程式BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr,反应类型:取代反应或水解反应,
故答案为:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr;取代反应或水解反应;
(4)I为HOCH2CH2OH、K为HOOCCOOH,二者发生缩聚反应生成高分子化合物,则I与K生成高分子化合物的化学方程式:n HOCH2CH2OH+n HOOC-COOH $→_{△}^{浓硫酸}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:n HOCH2CH2OH+n HOOC-COOH $→_{△}^{浓硫酸}$ +(2n-1)H2O;
+(2n-1)H2O;
(5)J与新制Cu(OH)2悬浊液反应的化学方程式:OHCCHO+4Cu(OH)2$\stackrel{△}{→}$HOOCCOOH+2Cu2O+4H2O,
故答案为:OHCCHO+4Cu(OH)2$\stackrel{△}{→}$HOOCCOOH+2Cu2O+4H2O.
点评 本题考查有机合成,为高频考点,侧重考查学生推断及综合知识运用能力,明确常见有机物官能团及其性质关系、物质之间的转化是解本题关键,注意醛和新制氢氧化铜悬浊液反应方程式的书写,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 向甲容器中再充人一定量的氦气 | B. | 向乙容器中再充人2mol的SO3气体 | ||
| C. | 适当降低乙容器的温度 | D. | 缩小甲容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯 | B. | 勒•夏特列 | C. | 门捷列夫 | D. | 凯库勒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 | |
| B. | 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸 硫酸铜 纯碱 干冰 | B. | 硝酸 硝酸银 熟石灰 干冰 | ||
| C. | 碳酸 纯碱 食盐 冰 | D. | 醋酸 食盐 烧碱 铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 吸热反应和熵减的反应都具有自发进行的倾向 | |
| C. | 正、逆反应速率都改变,化学平衡一定发生移动 | |
| D. | 同温同压下,H2(g)+Cl2(g)?2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com