
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
分析 通过添加过量的难溶电解质MnS,除去Cu2+、Pb2+、Cd2+等离子,是沉淀转化的原理,利用CuS、PbS、CdS比MnS更难溶与水的原理转化,以此解答该题.
解答 解:A.加入MnS,可生成CuS、PbS、CdS沉淀,说明CuS、PbS、CdS溶解度较小,故A错误;
B.加入硫化钠,可生成MnS沉淀,不能用于除杂,故B错误;
C.沉淀转化的离子方程式为:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),故C错误;
D.以MnO2为原料发生反应制得的MnCl2溶液,Mn元素化合价发生变化,属于氧化还原反应,沉淀的转化属于复分解反应,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握难溶电解质的溶解平衡的移动原理以及影响因素.


科目:高中化学 来源: 题型:解答题
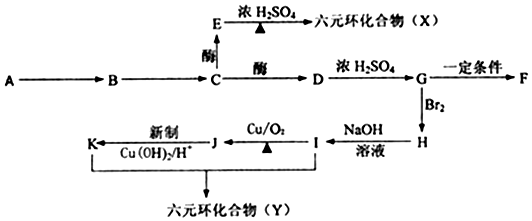
 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
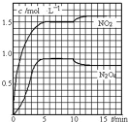 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| T1℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| T2℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
| A. | 由上述数据可以判断:T1℃>T2℃ | |
| B. | 该反应的焓变△H>0,升高温度K增大. | |
| C. | T1℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/(L•min) | |
| D. | T2℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算出反应达平衡后甲醇的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入氯化铵固体 | B. | 适当升高温度 | C. | 通入氨气 | D. | 加入少量浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
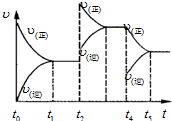 工业上生产硝酸的主要过程如下:
工业上生产硝酸的主要过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com