
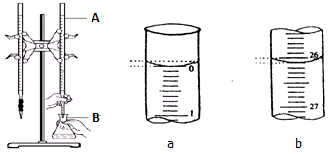
分析 (1)配制溶液,必须选相应规格的容量瓶;
(2)A的下端是活塞,故为酸式滴定管,而酸式滴定管只能盛放酸性溶液或强氧化性溶液;
(3)本题考查了盐酸与氢氧化钠反应的离子方程式的书写.
解答 解:(1)配制100mL溶液应当选用对应规格的容量瓶,即100mL容量瓶,故答案为:b;
(2)由图可知,A下端是活塞,故为酸式滴定管,可以盛放酸性、强氧化性溶液,故盛放的是盐酸;
故答案为:酸式滴定管;盐酸;
(3)锥形瓶B中发生的化学反应:NaOH+HCl=NaCl+H2O,离子方程式为H++OH-═H2O,故答案为:H++OH-═H2O.
点评 本题综合考查了容量瓶的选用、酸碱中和滴定的实验操作和反应原理,难度不大.


科目:高中化学 来源: 题型:解答题
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A. | 该反应方程式中的x=l | |
| B. | 0~t1时,用A表示的反应速率υ(A)=0.50mol/(L•min) | |
| C. | t2和t3时,改变的条件分别是加入催化剂和移去少量物质D | |
| D. | t1~t3间,该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3(s)=2KCl(s)+3O2(g)△H=-78.03 kJ•mol-1,△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)=C(s,石墨)+$\frac{1}{2}$O2(g)△H=110.5 kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H=-444.3 kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)=CH3COONH4 (aq)+CO2(g)+H2O(l)△H=37.30 kJ•mol-1,△S=184.0 J•mol-1•K-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器体积不变,充入与反应体系不反应的N2,反应速率不变;压强不变,充入N2,反应速率减小 | |
| B. | 升高温度时,正反应速率增大,逆反应速率也一定增大 | |
| C. | 恒温恒容下,若X、Y起始物质的量之比为2:1,则X、Y的转化率始终相等 | |
| D. | 恒温恒压下,该反应达到平衡后若只增加Z的量,重新达到平衡,各物质的物质的量之比可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
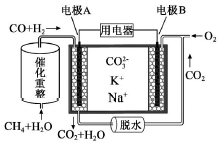
| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$ 3H2+CO,每消耗1molCH4转移12mol 电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com