
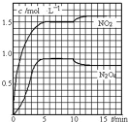
 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
分析 A.根据化学反应速率v=$\frac{△c}{△t}$计算前 5min 反应的平均速率 v(N2O4);
B.化学平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,代入相关数据来计算即可;
C.根据转化率=$\frac{反应消耗量}{总物质的量}$×100%利用化学平衡三段式列式计算;
D.根据温度对化学平衡移动的影响:升高温度,化学平衡向着吸热方向进行,反之向着放热方向进行,据此来判断反应的吸放热.
解答 解:A.前5min反应的平均速率v(N2O4)=$\frac{0.9mol/L}{5min}$=0.18mol•(L•min)-1,故A错误;
B.T1℃时反应②的化学平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.9}{(1.5)^{2}}$=0.4L/mol,故B错误;
C.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,则Qc=$\frac{\frac{2mol}{2L}}{(\frac{3.6mol}{2L})^{2}}$=0.31<K,所以反应正向进行,T1℃达到平衡时,
2NO2(g)?N2O4(g)
初始(mol/L):1.8 1.0
变化(mol/L):2x x
平衡(mol/L):1.8-2x (1.0+x)
平衡常数K=$\frac{1.0+x}{(1.8-2x)^{2}}$=0.4,解得:x=0.1,则N2O4的转化率为10%,故C正确;
D.在该题中,升高温度后,二氧化氮的浓度增加,四氧化二氮的浓度减小,所以平衡②逆向移动,该反应是放热的,故D错误;
故选C.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学反应速率、化学平衡常数的计算,注意掌握化学平衡常数、化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 盖斯 | B. | 勒•夏特列 | C. | 门捷列夫 | D. | 凯库勒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 吸热反应和熵减的反应都具有自发进行的倾向 | |
| C. | 正、逆反应速率都改变,化学平衡一定发生移动 | |
| D. | 同温同压下,H2(g)+Cl2(g)?2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度/(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 | |
| B. | 在温度、压强一定的条件下,自发反应总是向△G=△H-T△S<0的方向进行 | |
| C. | 水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 | |
| D. | 混乱度减小的吸热反应一定不能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com