
分析 (1)c(Ba2+)=0.010mol•L-1,当溶液中Ba2+开始沉淀,应满足c(Ba2+)×c(CrO42-)>1.2×10-10;
(2)当溶液中Ba2+沉淀完全时,可认为c(Ba2+)<1×10-5mol/L,以此计算c(CrO42-),结合c(Sr2+)×c(CrO42-)与Ksp[SrCrO4]的关系判断是否生成沉淀.
解答 解:(1)c(Ba2+)=0.010mol•L-1,当溶液中Ba2+开始沉淀时,c(CrO42-)=$\frac{1.2×1{0}^{-10}}{0.01}$mol/L=1.2×10-8mol/l,
答:溶液中CrO42-的浓度为1.2×10-8mol/l;
(2)当溶液中Ba2+沉淀完全时,可认为c(Ba2+)<1×10-5mol/L,c(CrO42-)=$\frac{1.2×1{0}^{-10}}{1×1{0}^{-5}}$mol/L=1.2×10-5mol/l,c(Sr2+)=0.010mol•L-1,
则c(Sr2+)×c(CrO42-)=0.01×1.2×10-5=1.2×10-7<2.2×10-5,则没有沉淀生成.
答:否.
点评 本题考查难溶电解质的溶解,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | a=4 | |
| B. | S2O32-是还原剂 | |
| C. | 将Y均匀分散到水中形成的体系具有丁达尔效应 | |
| D. | 每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
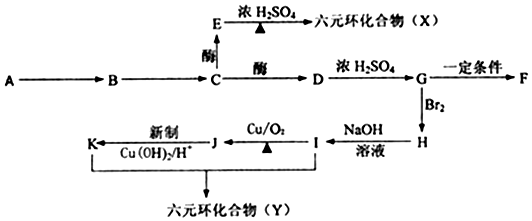
 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 氧气和臭氧的混合物16 g中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
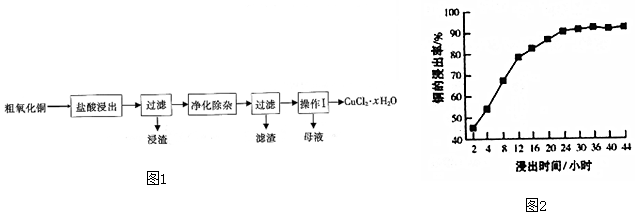
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
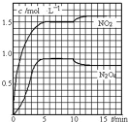 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| T1℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| T2℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
| A. | 由上述数据可以判断:T1℃>T2℃ | |
| B. | 该反应的焓变△H>0,升高温度K增大. | |
| C. | T1℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/(L•min) | |
| D. | T2℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算出反应达平衡后甲醇的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上生产硝酸的主要过程如下:
工业上生产硝酸的主要过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com