
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元素①﹣⑩在表中的位置回答下列问题。
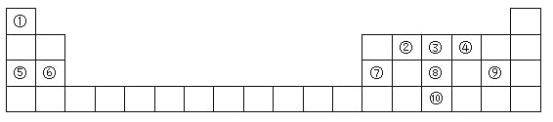
(1)画出⑩的原子结构示意图:______________________;
(2)③、④、⑧的气态氢化物稳定性由小到大的顺序是:(填化学式)__________________;
(3)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是:(填化学式)__________________;
(4)②、④两元素形成的AB2型物质的电子式是:_______________________;
(5)①、④、⑤、⑨中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式:________________________________
【答案】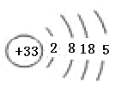 PH3<NH3<H2O HClO4>H3PO4
PH3<NH3<H2O HClO4>H3PO4 ![]() NaOH或NaClO或Na2O2
NaOH或NaClO或Na2O2
【解析】
由元素在周期表中的相对位置可以知道:①是H、②是C、③是N、④是O、⑤是Na、⑥是Mg、⑦是Al、⑧是P、⑨是Cl、⑩是As。
(1)⑩是As,核电荷数33,原子核外四个电子层,最外层5个电子,原子结构示意图为:![]() ,故本题正确答案是:
,故本题正确答案是:![]() ;
;
(2)非金属性越强对应气态氢化物越稳定,③、④、⑧的气态氢化物是:NH3、H2O、PH3,稳定性由小到大的顺序PH3<NH3<H2O,故本题正确答案是:PH3<NH3<H2O;
(3)非金属性越强,最高价含氧酸的酸性越强,⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是,HClO4>H3PO4,故本题正确答案是:HClO4>H3PO4;
(4)②、④两元素形成的AB2型物质为CO2,碳原子和两个氧原子分别形成两个共用电子对,其电子式为:![]() ,故本题答案为:
,故本题答案为:![]() ;
;
(5)H、O、Na、Cl中的某些元素可形成既含离子键又含共价键的化合物有NaOH或NaClO或Na2O2,故本题答案为:NaOH或NaClO或Na2O2。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,由这四种元素形成的一种盐溶液,遇到FeCl3溶液呈现血红色,该盐溶液与NaOH在加热条件下会生成一种能使湿润的红色石蕊试纸变蓝的气体。下列说法正确的是( )
A.W和X形成的化合物在常温下均为气态
B.X元素可以形成多种具有广泛用途的单质
C.X和Z的最高价氧化物对应水化物都是强酸
D.Y的简单离子与Z的简单离子具有相同的电子层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛风性关节病的发病机理和尿酸钠有关。室温下,将尿酸钠( NaUr)的悬浊液静置,取上层清液滴加盐酸,溶液中尿酸的浓度c(HUr)与pH的关系如图所示。已知Ksp(NaUr)=4.9×10-5 mol2·L-2,Ka(HUr)=2.0×10-6 mol·L-1。下列说法正确的是

A.上层清液中,c(![]() )= 7.0×10-2 mol·L-1
)= 7.0×10-2 mol·L-1
B.M→N的变化过程中,c(Na+)·c(Ur-)的值将逐渐减小
C.当c(HUr)=c(Ur-)时,c(Cl-)>c(Ur-)
D.当pH=7时,2c(Na+)=c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃双环[2.2.1]庚烷的结构简式如图所示,下列关于该化合物的说法错误的是
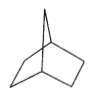
A. 与环庚烯互为同分异构体
B. 二氯代物结构有9种
C. 所有碳原子不能处于同一平面
D. 1mol双环[2.2.1]庚烷完全燃烧至少需要10 molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图,
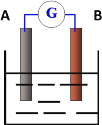
(1)若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为________极 (填正或负),写出电极反应式:正极____________负极_________________。
(2)若A为Zn,B为Cu,电解质溶液为稀硫酸,则A电极名称为 _________,写出正极的电极反应式___________。
(3)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47g,试计算产生标准状况氢气的体积为多少L?(请写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)。
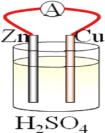
(1)负极是__(填“铜”或“锌”),__电子(填“失去”或“得到”),发生__反应(填“氧化”或“还原”),电极反应方程式___;正极是__(填“铜”或“锌”)__电子(填“失去”或“得到”),发生__反应(填“氧化”或“还原”),电极反应方程式__。
(2)电流由___流向___(填“铜”或“锌),铜片上观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
A. 生成44.8L N2(标准状况)
B. 有0.25 mol KNO3被还原
C. 转移电子的物质的量为1.75mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com