
����Ŀ�����Ȼ����Ǻϳɲ���������Ҫԭ�ϣ�
��1�����ù�ҵFeCl3��ȡ�����IJ���������[Fe2��C2O4��35H2O]��ʵ��������ͼ��ʾ�� 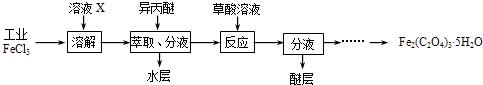
��Ϊ����FeCl3ˮ�⣬��ҺXΪ ��
������������FeCl3�ܱ��������ȡ����ԭ������������ȡ����Һ������ˮ�����Ƿ���Fe3+�ķ����� ��
������Fe2��C2O4��35H2O���ñ�ˮϴ�ӣ���Ŀ���� ��
��Ϊ�ⶨ���ò���������Ĵ��ȣ�ʵ���ҳ�ȡa g��Ʒ���������ữ����KMnO4����Һ�ζ����ɵ�H2C2O4 �� KMnO4����ҺӦ������ͼ��ʾ��������ס����ҡ����У�������������ʵ����Fe2��C2O4��35H2O����ƫ�͵��� ��
a��ʢ��KMnO4�ĵζ���ˮϴ��δ�ñ�Һ��ϴ
b���ζ��ܵζ�ǰ���첿�������ݣ��ζ�����ʧ
c���ζ�ǰ���Ӷ������ζ����Ӷ���
��2��ij�о���ѧϰС������ʴ�̶�ͭ��·�����÷�Һ������ΪFeCl2��CuCl2��FeCl3���������Ʊ�����ͭ����ˮFeCl3 �� ����FeCl3�ϳ�Fe2��C2O4��35H2O���벹��������ʴ�̷�Һ�Ʊ�����ͭ����ˮFeCl3��ʵ�鲽�裨��ѡ�õ��Լ������ۡ����ᡢNaOH��Һ��H2O2��Һ�������Һ�м����������ۣ���ַ�Ӧ����ˣ���������ҺpH������Һ����Ũ������ȴ�ᾧ�����ˡ�ϴ�Ӹ����FeCl36H2O�� �� �õ���ˮFeCl3 �� ![]()
���𰸡�
��1����Ũ�����FeCl3��������е��ܽ�ȴ�������ˮ�е��ܽ�ȣ�ȡ������Һ�������еμ�����KSCN��Һ������Һ��죬����Fe3+����ȥ���ʡ����ٲ�����������ܽ���ģ��ף�c
��2���������м�������HCl����ַ�Ӧ����ˡ�ϴ�ӡ������ͭ�ۣ������ι���������Һ�ϲ��������м�������H2O2��Һ��Fe2+ȫ������Fe3+����FeCl3?6H2O��HCl�������м�����ˮ
���������⣺��1�����ữFeCl3�������ữ�����������ʣ������������ӵ�ˮ�⣬���Դ��ǣ���Ũ���������ȡ�����������ڲ�ͬ�ܼ��е��ܽ�Ȳ��������ȡ���ʵ�һ�ַ���������ȡ˵��FeCl3��������е��ܽ�ȴ�������ˮ�е��ܽ�ȣ�����Fe3+��KSCN��ҺЧ����ã����Դ��ǣ�FeCl3��������е��ܽ�ȴ�������ˮ�е��ܽ�ȣ�ȡ������Һ�������еμ�����KSCN��Һ������Һ��죬����Fe3+����ϴ���dz�ȥ�����������ʣ���ˮ�Ǽ��ٳ����ܽ���ʧ�����Դ��ǣ���ȥ���ʡ����ٲ�����������ܽ���ģ���KMnO4����Һ����ǿ�����ԣ�Ӧ������ʽ�ζ����У�a��û����ϴ���¸������Ũ�ȵ���������࣬ƫ�ߣ�
b�����������������࣬ƫ�ߣ�
c���������ƫС�����ƫ�ͣ���ȷ��
���Դ��ǣ��ף�c����2���ù��������������������˫��ˮ����Ϊ�����ӣ���ʵ���Ŀ���ǵõ�ͭ���ʣ���Ӧ���ɵ���ͭ��ʣ�����Ļ�������������ȥͭ�е��������ѷ�Ӧ��Һ��ǰ�κϲ����ʲ���Ϊ�������м�������HCl����ַ�Ӧ����ˡ�ϴ�ӡ������ͭ�ۣ������ι���������Һ�ϲ��������м�������H2O2��Һ��Fe2+ȫ������Fe3+��ֱ�Ӽ���FeCl36H2O��ˮ�⣬Ϊ����ˮ������HCl��Χ�½��У�
���Դ��ǣ��������м�������HCl����ַ�Ӧ����ˡ�ϴ�ӡ������ͭ�ۣ������ι���������Һ�ϲ��������м�������H2O2��Һ��Fe2+ȫ������Fe3+����FeCl36H2O��HCl�������м�����ˮ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ�����ʾ���ʵ�ֵ��ǣ� ��
A.Fe ![]() Fe2O3
Fe2O3 ![]() Fe2��SO4��3
Fe2��SO4��3
B.N2 ![]() NO2
NO2 ![]() HNO3
HNO3
C.S ![]() SO2
SO2 ![]() H2SO4
H2SO4
D.AgNO3��aq�� ![]() Ag��NH3��2OH��aq��
Ag��NH3��2OH��aq�� ![]() Ag
Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�����и�����Һ��Ϻ���Һһ�������Ե��ǣ� ��
A.������������ʵ���Ũ�ȵİ�ˮ��������
B.pH֮��Ϊ14�İ�ˮ�������������
C.pH֮��Ϊ14��Ba��OH��2��Һ��NaHSO4��Һ��������
D.������������ʵ���Ũ�ȵ�Ca��OH��2��Һ��Na2CO3��Һ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�T1��T2ʱ���ֱ�0.50mol CH4��1.20mol NO2�������Ϊ1L���ܱ������У��������·�Ӧ��CH4��g��+2NO2��g��N2��g��+CO2��g��+2H2O��g�������n��CH4����ʱ��仯�������±���
ʱ��/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n��CH4��/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n��CH4��/mol | 0.50 | 0.30 | 0.18 | �� | 0.15 |
����˵����ȷ���ǣ� ��
A.T2ʱCH4��ƽ��ת����Ϊ70.0%
B.�÷�Ӧ�ġ�H��0��T1��T2
C.���������������䣬T1ʱ��ƽ����ϵ���ٳ���0.30 mol CH4��0.80 mol H2O��g����ƽ��������Ӧ�����ƶ�
D.���������������䣬T1ʱ��ƽ����ϵ���ٳ���0.50 mol CH4��1.20 mol NO2 �� ��ԭƽ����ȣ�����ƽ��ʱN2��Ũ���������������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�е��ܽ����ĺ����Ǻ���ˮ�ʵ�һ����Ҫָ�꣬ijʵ����ȤС��ͨ�����²���������ˮ���ܽ����ĺ����� ����һ�����ܽ�������ƿ��ע��20.00mLˮ�����ٷֱ����1mL 0.1molL��1MnSO4��Һ��3mL NaOH��KI�Ļ����Һ����ַ�Ӧ����ʱ������Ӧ�Ļ�ѧ����ʽΪ��Mn2++2OH���TMn��OH��2�� 2Mn��OH��2+O2�T2MnO��OH��2
�������������������м���1.5mLŨ���ᣬ��ַ�Ӧ���Ƴ�����ȫ�ܽ⣬��ʱ��Һ�ʻ�ɫ��
������������Һȫ��ת�Ƶ�����ƿ�У������еμ�23�ε�����Һ����Һ����ɫ���� 0.005molL��1��Na2S2O3����Һ�ζ�����ɫǡ����ʧ��������Na2S2O3����Һ3.60mL����ʱ������ӦΪ��I2+2Na2S2O3�T2NaI+Na2S4O6
��1��25��ʱ������һ�е�����NaOHʹ��Һ��pH=12ʱ����ʱ��Һ�е�c��Mn2+��=molL��1 �� ����֪ KspMn��OH��2=2.06��10��13��
��2��д�����������������Ӧ�Ļ�ѧ����ʽ��
��3�������ˮ�����ܽ����ĺ���������λ��mgL��1 �� ��д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������250mL0.2mol��L-1�Ȼ�����Һ�IJ��裺
���ܽ��ϴ�Ӣ���Һ�ܼ���ݶ��ݢ����߸Ǻ�ƿ�����������µߵ���ҡ�ȡ�����ѡ������Һ���ƵIJ����Ⱥ�˳����
A. �ڢۢݢ٢ޢߢ� B. �ܢޢ٢ۢڢݢ�
C. �ܢڢݢޢ٢ۢ� D. �ڢޢߢܢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ֱ���A��B�������ʵĺ˴Ź������ף���֪A��B�������ʶ������࣬������6����ԭ�ӣ��Ը����������ʵĺ˴Ź��������Ʋ�A��B�п���������ģ� �� 
A.A��C3H6 �� B��C6H6
B.A��C2H6 �� B��C3H6
C.A��C2H6 �� B��C6H6
D.A��C3H6 �� B��C2H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A | B | C | D |
��բ�����ױ���ʴ | a��b��Ϊ���Ե缫��b����Ӧ�ǣ�O+4OH����4e��=2H2O | �������������ɵ���������ʵ���֮����1��1 | ��ع���һ��ʱ�� |
|
|
|
|
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪M2O7x-+3 S2-+ 14 H��="2" M 3��+ 3S��+7H2O����M2O7x-�е�M�Ļ��ϼ�Ϊ�� ��
A. ��2 B. ��3 C. ��4 D. ��6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com