
����Ŀ��ˮ�е��ܽ����ĺ����Ǻ���ˮ�ʵ�һ����Ҫָ�꣬ijʵ����ȤС��ͨ�����²���������ˮ���ܽ����ĺ����� ����һ�����ܽ�������ƿ��ע��20.00mLˮ�����ٷֱ����1mL 0.1molL��1MnSO4��Һ��3mL NaOH��KI�Ļ����Һ����ַ�Ӧ����ʱ������Ӧ�Ļ�ѧ����ʽΪ��Mn2++2OH���TMn��OH��2�� 2Mn��OH��2+O2�T2MnO��OH��2
�������������������м���1.5mLŨ���ᣬ��ַ�Ӧ���Ƴ�����ȫ�ܽ⣬��ʱ��Һ�ʻ�ɫ��
������������Һȫ��ת�Ƶ�����ƿ�У������еμ�23�ε�����Һ����Һ����ɫ���� 0.005molL��1��Na2S2O3����Һ�ζ�����ɫǡ����ʧ��������Na2S2O3����Һ3.60mL����ʱ������ӦΪ��I2+2Na2S2O3�T2NaI+Na2S4O6
��1��25��ʱ������һ�е�����NaOHʹ��Һ��pH=12ʱ����ʱ��Һ�е�c��Mn2+��=molL��1 �� ����֪ KspMn��OH��2=2.06��10��13��
��2��д�����������������Ӧ�Ļ�ѧ����ʽ��
��3�������ˮ�����ܽ����ĺ���������λ��mgL��1 �� ��д��������̣�
���𰸡�
��1��2.06��10��9
��2��MnO��OH��2+2H2SO4+2KI=MnSO4+K2SO4+I2+3H2O
��3���⣺�ɻ�ѧ����ʽ��֪��O24Na2S2O3��
n��O2��= ![]() ��0.005molL��1��3.60��10��3L=4.5��10��6mol
��0.005molL��1��3.60��10��3L=4.5��10��6mol
�ܽ����ĺ����T4.5��10��6mol��16g/mol�� ![]() =7.2g/L=7.2 mgL��1��
=7.2g/L=7.2 mgL��1��
�𣺸�ˮ�����ܽ����ĺ���Ϊ7.2 mgL��1
���������⣺��1������NaOHʹ��Һ��pH=12ʱ��c��H+��=10��12mol/L��c��OH����=10��2mol/L����� KspMn��OH��2=2.06��10��13���㣬KspMn��OH��2=c��Mn2+��c2��OH����=2.06��10��13����õ���c��Mn2+��=2.06��10��9 �� ���Դ��ǣ�2.06��10��9����2�����ܽ�������ƿ��ע��20.00mLˮ�����ٷֱ����1mL 0.1molL��1MnSO4��Һ��3mL NaOH��KI�Ļ����Һ����ַ�Ӧ����ʱ������Ӧ�Ļ�ѧ����ʽΪ��Mn2++2OH���TMn��OH��2�� 2Mn��OH��2+O2�T2MnO��OH��2 �� ������������м���1.5mLŨ���ᣬ��ַ�Ӧ���Ƴ�����ȫ�ܽ⣬��ʱ��Һ�ʻ�ɫ��˵��MnO��OH��2 ����KI���ɵⵥ�ʣ���Ӧ�Ļ�ѧ����ʽΪ��MnO��OH��2+2H2SO4+2KI=MnSO4+K2SO4+I2+3H2O��
���Դ��ǣ�MnO��OH��2+2H2SO4+2KI=MnSO4+K2SO4+I2+3H2O��


 ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ڳ��ʱ�����أ��ŵ�ʱ��ԭ��أ�Ǧ��������������������һ���������Ա��С�+������һ���������Ա��С����������ڱ��С�+���Ľ�����������˵������ȷ���ǣ� ��
A.���ʱ���������ŵ�ʱ������
B.���ʱ���������ŵ�ʱ������
C.���ʱ���������ŵ�ʱ������
D.���ʱ���������ŵ�ʱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȿ�������������������ϩ���ֿ���������ȥ�����е���ϩ�Եõ���������ķ����ǣ� ��
A. ͨ��������NaOH��aq��
B. ͨ����������ˮ
C. ��Ni��������������ͨ��H2
D. ͨ������������KMnO4��aq��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����һ��ҽҩ�м��壮��ṹ��ʽ��ͼ��ʾ�������йظ����ʵ�˵����ȷ���ǣ� �� 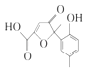
A.�û���������в�������̼ԭ��
B.�û�������NaHCO3��Һ������CO2����ų�
C.1 mol�û�������������ˮ��Ӧ������2 mol Br2
D.��һ�������£��û�������HCHO�ܷ������۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F��һ�����ƹؽ���ֹʹҩ���ϳ�F��һ�ִ�ͳ��·����ͼ�� 
��1��B�к��������ŵ�����Ϊ ��
��2��C��D�ķ�Ӧ�ɷ�Ϊ�������䷴Ӧ����Ϊ�� ��
��3��д����F��5��̼ԭ�ӵ�ͬϵ��X�Ľṹ��ʽ����дһ�֣���X�ж���ͬ���칹�壬��������������X��ͬ���칹�干���֣� �����ڷ����廯���� �ڱ�����ֻ��1��ȡ���� ��������������
��4��д��Eת��ΪF�����εĻ�ѧ����ʽ�� ��
��5����֪�� �� ![]() ��
�� ![]() ��R��R���ʾ������
��R��R���ʾ������
�ϳ�F��һ�ָ���������2������1������[��CH3��2CHCH2OH��]������������[��CH3CO��2O]Ϊԭ�����ϳɣ�д���йصĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH��
CH3CH2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ����Ǻϳɲ���������Ҫԭ�ϣ�
��1�����ù�ҵFeCl3��ȡ�����IJ���������[Fe2��C2O4��35H2O]��ʵ��������ͼ��ʾ�� 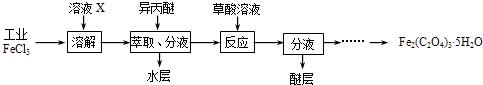
��Ϊ����FeCl3ˮ�⣬��ҺXΪ ��
������������FeCl3�ܱ��������ȡ����ԭ������������ȡ����Һ������ˮ�����Ƿ���Fe3+�ķ����� ��
������Fe2��C2O4��35H2O���ñ�ˮϴ�ӣ���Ŀ���� ��
��Ϊ�ⶨ���ò���������Ĵ��ȣ�ʵ���ҳ�ȡa g��Ʒ���������ữ����KMnO4����Һ�ζ����ɵ�H2C2O4 �� KMnO4����ҺӦ������ͼ��ʾ��������ס����ҡ����У�������������ʵ����Fe2��C2O4��35H2O����ƫ�͵��� ��
a��ʢ��KMnO4�ĵζ���ˮϴ��δ�ñ�Һ��ϴ
b���ζ��ܵζ�ǰ���첿�������ݣ��ζ�����ʧ
c���ζ�ǰ���Ӷ������ζ����Ӷ���
��2��ij�о���ѧϰС������ʴ�̶�ͭ��·�����÷�Һ������ΪFeCl2��CuCl2��FeCl3���������Ʊ�����ͭ����ˮFeCl3 �� ����FeCl3�ϳ�Fe2��C2O4��35H2O���벹��������ʴ�̷�Һ�Ʊ�����ͭ����ˮFeCl3��ʵ�鲽�裨��ѡ�õ��Լ������ۡ����ᡢNaOH��Һ��H2O2��Һ�������Һ�м����������ۣ���ַ�Ӧ����ˣ���������ҺpH������Һ����Ũ������ȴ�ᾧ�����ˡ�ϴ�Ӹ����FeCl36H2O�� �� �õ���ˮFeCl3 �� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ϣ�ͱ�־���ж�����˵������ȷ���ǣ� ��
A | B | C | D |
|
|
|
|
�Ŵ��й�������������ƿ��� | ����ɱ�������������ϴ��Ư�� | ������������������Һ�����ܽ� | ��ֽ�����ϡ��������������ɻ��� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ���У������Լ������ﵽ�����Ŀ�ĵ���
A.����ˮ���𱽺ͼ�ϩB.��������Һ���������Ǻ���ȩ
C.�ý����Ƽ����Ҵ�����ȩD.��̼������Һ�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dzµ��㡱��������Ϊ���ڴ������������������ ζ��������������ʵ��������Ҳ����������ͼ��ʾ��װ����ȡ����������
�ش��������⣺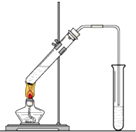
��1��д����ȡ���������Ļ�ѧ��Ӧ����ʽ
��2������̼������Һ����Ҫ���������� ��
��3��װ����ͨ�����ĵ���Ҫ���ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ���� ��
��4����Ҫ���Ƶõ������������������Ӧ���õ�ʵ������� ��
��5������ʵ��ʱ����ʱ����ʢ������Ҵ����Թ�����뼸�����Ƭ����Ŀ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com