
【题目】在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A.T2时CH4的平衡转化率为70.0%
B.该反应的△H>0、T1<T2
C.保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2 , 与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
【答案】AD
【解析】解:由表中数据可知,T1温度在40min到达平衡,开始对应各组分浓度相等,前20min内温度T2的反应速率大于温度T1的,则温度T2>T1 , T2温度先到达平衡,到达平衡时间小于40min,50min处于平衡状态,此时甲烷的物质的量为0.15mol,大于T1温度平衡时的0.1mol,说明平衡逆向移动,则正反应为放热反应,A.T2平衡时参加反应的甲烷物质的量为:0.5mol﹣0.15mol=0.35mol,则甲烷的平衡转化率为: ![]() ×1005=70%,故A正确;
×1005=70%,故A正确;
B.根据分析可知,温度T1<T2 , 正反应为放热反应,该反应的△H<0,故B错误;
C.保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),此时甲烷浓度为0.4mol/L,原平衡时生成的水为(0.5﹣0.1)mol×2=0.8mol,此时水的浓度为1.6mol/L,根据K= ![]() 可知此时Qc=6.4=K,反应向逆反应进行,故C错误;
可知此时Qc=6.4=K,反应向逆反应进行,故C错误;
D.再充入0.50molCH4和1.20molNO2 , 平衡正向移动,氮气浓度增大,等效为在原平衡基础增大压强,与原平衡相比平衡逆向移动,达新平衡时N2的体积分数减小,故D正确;
故选AD.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是(填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究浓硫酸和铜的反应,下列装置或操作正确的是( )
A.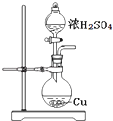 用装置进行铜和浓硫酸的反应
用装置进行铜和浓硫酸的反应
B.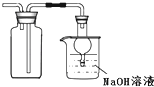 用装置收集二氧化硫并吸收尾气
用装置收集二氧化硫并吸收尾气
C.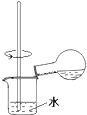 用装置稀释反应后的混合液
用装置稀释反应后的混合液
D.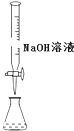 用装置测定余酸的浓度
用装置测定余酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是一种医药中间体.其结构简式如图所示.下列有关该物质的说法正确的是( ) 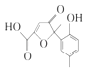
A.该化合物分子中不含手性碳原子
B.该化合物与NaHCO3溶液作用有CO2气体放出
C.1 mol该化合物与足量溴水反应,消耗2 mol Br2
D.在一定条件下,该化合物与HCHO能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组溶液混合后,溶液一定呈中性的是( )
A.等体积、等物质的量浓度的氨水与盐酸混合
B.pH之和为14的氨水与硝酸等体积混合
C.pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合
D.等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是合成草酸铁的重要原料.
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)35H2O]的实验流程如图所示: 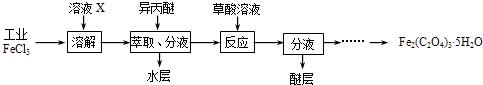
①为抑制FeCl3水解,溶液X为 .
②上述流程中FeCl3能被异丙醚萃取,其原因是;检验萃取、分液后所得水层中是否含有Fe3+的方法是 .
③所得Fe2(C2O4)35H2O需用冰水洗涤,其目的是 .
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4 , KMnO4标准溶液应置于右图所示仪器(填“甲”或“乙”)中.下列情况会造成实验测得Fe2(C2O4)35H2O含量偏低的是 .
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3 , 再由FeCl3合成Fe2(C2O4)35H2O.请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl36H2O; , 得到无水FeCl3 . ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度为2.68g/L(折算成标准状况),该有机物能与金属钠反应.试回答:
(1)通过计算求出该有机物的分子式.
(2)写出该有机物可能的结构简式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com