
【题目】在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g)+3N(g)![]() xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A. x值为2 B. 混合气体的密度增大
C. N的转化率为80% D. 混合气体平均摩尔质量不变,不能说明该反应达平衡
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
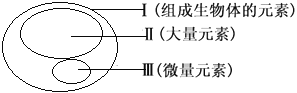
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法中正确的是
A. 4g甲烷完全燃烧转移的电子数为2NA
B. 11.2L(标准状况)CCl4中含有的共价键数为2NA
C. 3 mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. 1L 0.1mol·L-1的Na2S溶液中HS-和S2-离子数之和为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱碳:
向2L密闭容器中加入2mol CO2、8mol H2,在适当的催化剂作用下,发生反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
(1)该反应自发进行的条件是_______(填“低温”、“高温”或“任意温度”)
(2)下列叙述能说明此反应达到平衡状态的是_______________。
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数比为1﹕4
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有4mol H-H键断裂
Ⅱ.脱硝:
(3)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为__________。
(4)温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
甲 | 0.6 | 0 | 0 | 0.2 |
乙 | 0.3 | 0.5 | 0.2 | |
丙 | 0 | 0.5 | 0.35 | |
A.容器甲中发生反应的平衡常数为0.8
B.容器乙中起始时反应正向进行
C.达到平衡时,容器丙中c(O2)/c(NO2)>1
D.达到平衡时,容器甲与容器丙中的总压强之比为16∶17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g) +B(g) ![]() xC(g) +2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g) +2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于_________;
(2)A的转化率为____________;
(3)生成D的反应速率为_________________;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 Urolithin A常用于合成某药物,其结构简式如图所示。下列说法错误的是
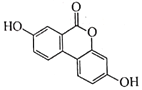
A. Urolithin A分于中苯环上的一氯代物有6种
B. Urolithin A分子中所有原子不可能共平面
C. Urolithin A能发生加成、取代和氧化反应
D. Urolithin A在稀硫酸中的水解产物含2种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是很好的净水剂,高铁酸钡( BaFeO4)是高能电池阳极的优良材料。已知:K2FeO4为紫色固体,微溶于KOH溶液,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定;在碱性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4难溶于水和碱性溶液。某化学兴趣小组欲制取“84”消毒液,进而制取少量K2FeO4和 BaFeO4。请回答下列问题:
(实验一)选择合适的仪器和试剂制取氯气,进而制备高浓度的“84”消毒液。

(1)选择合适的仪器,导管接口正确的连接顺序为___________;所选装置(A或B)中发生反应的离子方程式为______________________。
(实验二)用“84”消毒液制取K2FcO4
实验步骤:①用如图所示装置(夹持仪器略去)使反应物充分反应;②用砂芯漏斗对烧杯中的溶液进行抽滤,向滤液中慢慢加入KOH溶液;③再用砂芯漏斗对步骤②的最后反应混合物进行抽滤,并用苯、乙醚洗涤沉淀,真空干燥后得K2FeO4。

(2)写出步骤①中物质在20℃冷水浴中发生反应的化学方程式:______________________。
(3)步骤②中能够发生反应的原因是______________________,步骤③中不用水,而用苯、乙醚洗涤沉淀的目的是_________________________________。
(实验三)将上述产品配成K2FeO4碱性溶液,再慢慢加入Ba(OH)2溶液,抽滤得 BaFeO4。
(4)若投入ag硝酸铁晶体,得到bg高铁酸钡,则高铁酸钡的产率是___________。[已知Fe(NO3)3·9H2O的摩尔质量为404g·mol-1, BaFeO4的摩尔质量为257g·mol-1]
(实验四)利用如图所示电解装置也可以制得 BaFeO4。

(5)在___________(填“阳极区”或“阴极区”)可得到高铁酸钡,阳极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com