
【题目】一定条件下,充分燃烧一定量的丁烷生成二氧化碳和气态水时放出热量Q kJ(Q>0)。经测定完全吸收生成的CO2需消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐。则此条件下反应C4H10(g)+13/2O2(g)![]() 4CO2(g)+5H2O(g)的ΔH为( ) kJ·mol-1
4CO2(g)+5H2O(g)的ΔH为( ) kJ·mol-1
A. +8Q B. +16Q C. -8Q D. -16Q
【答案】D
【解析】
KOH的物质的量为0.1L×5mol/L=0.5mol,根据钾离子守恒,故n(K2CO3)=0.25mol,根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,根据碳元素守恒可知,丁烷的物质的量为0.25mol×![]() =0.0625mol,即0.0625mol丁烷放出的热量大小为QkJ,据此计算。
=0.0625mol,即0.0625mol丁烷放出的热量大小为QkJ,据此计算。
KOH的物质的量为0.1L×5mol/L=0.5mol,根据钾离子守恒,故n(K2CO3)=0.25mol,根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,根据碳元素守恒可知,丁烷的物质的量为0.25mol×![]() =0.0625mol,即0.0625mol丁烷放出的热量大小为QkJ,故1mol丁烷完全燃烧放出的热量为16QkJ,所以C4H10(g)+13/2O2(g)
=0.0625mol,即0.0625mol丁烷放出的热量大小为QkJ,故1mol丁烷完全燃烧放出的热量为16QkJ,所以C4H10(g)+13/2O2(g)![]() 4CO2(g)+5H2O(g)的ΔH=-16QkJ·mol-1,故选D。
4CO2(g)+5H2O(g)的ΔH=-16QkJ·mol-1,故选D。


科目:高中化学 来源: 题型:
【题目】下列各选项中两种粒子所含电子数不相等的是
A. 羟甲基(-CH2OH)和甲氧基(CH3O-) B. 亚硝酸(HNO2)和亚硝酸根(NO![]() )
)
C. 硝基(-NO2)和二氧化氮(NO2) D. 羟基(-OH)和氢氧根(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成红黄色的易爆物二氧化氯。
(1)请完成该过程的化学方程式并配平。
____KClO3+___HCl(浓)===____KCl+____ClO2↑+____Cl2↑+___(_________)
(2)浓盐酸在反应中显示出来的性质是__(填写编号)。
①氧化性 ②还原性 ③酸性 ④碱性
(3)若反应生成0.1molCl2,则转移的电子数为__。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1kgClO2相当于___kgCl2。(提示:Cl2和ClO2在消毒过程中均变为Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸银是中学实验室常用试剂。硝酸银不稳定,易发生如下反应:
①2AgNO3(s)= 2Ag(s)+ 2N02(g)+O2(g) △H1
②2NO2(g)![]() N2O4(g) △H2
N2O4(g) △H2
(1)2AgNO3(s)= 2Ag(s)+N2O4(g)+O2(g) △H=___________(用含△H1、△H2的式子表示)。
(2)实验室配制硝酸银溶液的操作方法是:将一定量硝酸银固体溶于浓硝酸中,加水稀释至指定体积。“硝酸”的作用是____________________________________________。
(3)一定温度下,在5L的恒容密闭容器中投入34 g AgNO3(s)并完全分解测得混合气体的总物质的量(n)与时间(t)的关系如图所示。
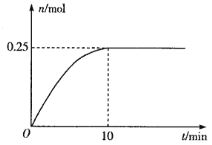
①下列情况能说明体系达到平衡状态的是___________(填字母)
a.Ag粉的质量不再改变 b.O2的浓度不再改变
c.NO2的体积分数不再改变 d.混合气体的密度不再改变
②反应开始到10min内N2O4的平均反应速率为___________mol·L-1·min-1。
③若达到平衡时,混合气体的总压强p=3.0MPa。在该温度下2NO2(g)![]() N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(
N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(![]() )]
)]
④达到平衡后,再向容器中充入少量的NO2,平衡2NO2(g)![]() N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
(4)已知几种难溶物的溶度积如下表所示:
难溶物 | AgI | AgSCN | AgCl | Ag2CrO4 | Ag2S |
溶度积 | 8.5×10-17 | 1.2x10-12 | 1.8×10-10 | 1.1×10-11 | 6.7×10-50 |
颜色 | 黄色 | 白色 | 白色 | 红色 | 黑色 |
实验室常用AgNO3溶液滴定Cl-,宜选择___________作指示剂(填字母)
A.KI B. NH4SCN C. Na2CrO 4 D.K2S
(5)工业上,常用电解法精炼粗银。粗银中含有Cu、Au等杂质,用AgNO3溶液作电解质溶液。若以电流强度aA,通电bmin后,制得精银的质量为ckg,则该精炼装置的电流效率为___________(只要求列出计算式即可)。[已知:1mol电子带96500C(库仑)电量,电流效率等于阴极得电子数与通过电子总数之比]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”ke牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D、E、F、G、H均为有机化合物。

回答下列问题:
(1)有机化合物A的相对分子质量小于60,A能发生银镜反应,1 mol A在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是__________________,由A生成B的反应类型是__________;
(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C 生成D的化学方程式是_________________________________________________;
(3)①芳香族化合物E的分子式是C8H8Cl2 ,E的苯环上的一溴取代物只有一种,则E的所有可能的同分异构体共有________种;
②E在NaOH溶液中可转变为F,F用高锰酸钾酸性溶液氧化生成G(C8H6O4)。1 mol G与足量的NaHCO3溶液反应可放出44.8 L CO2(标准状况),由此确定E的结构简式是_____________________________________;
(4)G和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是________________________________________________________该反应的反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。
(3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。
(4)判断SO42—已沉淀完全的方法是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com