
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3mol O2和0.3mol H2OB.![]() 个
个![]() 与0.1mol
与0.1mol ![]()
C.0.1mol ![]() 与0.15mol
与0.15mol ![]() D.0.1mol
D.0.1mol ![]() 与0.1mol
与0.1mol ![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
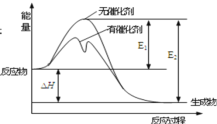
A.该反应正反应的活化能小于逆反应的活化能
B.该反应的逆反应为放热反应
C.使用催化剂使该反应的反应热发生改变
D.该反应的ΔH=E2-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)取3.0 g有机物X,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式________。X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(2)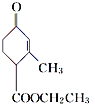 中的含氧官能团名称是________。
中的含氧官能团名称是________。
(3)分子式为C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为___________。
(4)肉桂酸苯甲酯G是一种香料,主要用于配制人造龙涎香,也可作皂用、化妆用及食用香精的调香原料。如图是用乙烯和甲苯为原料合成肉桂酸苯甲酯的路线图。
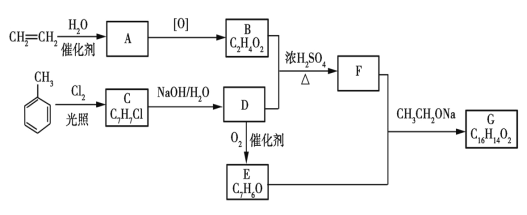
已知:RCHO+CH3COOR'![]() RCH=CHCOOR'。回答下列问题:
RCH=CHCOOR'。回答下列问题:
①A的结构简式是________,F的分子式是___________。
②C生成D的化学方程式是____________。
③D生成E的反应类型是__________。
④含有苯环,与D互为同分异构体的有机物有_____种(不考虑立体异构),其中不能与Na反应的结构简式是___________。
⑤G的结构简式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)aFeb(SO4)c·dH2O又称莫尔盐,是浅绿色晶体,用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
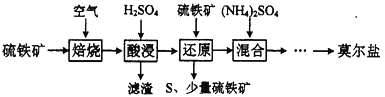
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:__________________________。实验室检验“还原”已完全的方法是:__________________________。
(2)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398g;另取25.00mL该溶液用0.0200mol/LKMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式(请写出计算过程)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]。
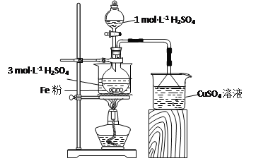
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)实验装置
反应过程中会产生少量PH3气体,需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为___。
(2)药品用量
将2gFe粉、10mL3mol·L-1H2SO4溶液加入烧瓶中反应。采取该原料配比的主要原因是___。
(3)制备FeSO4溶液
保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。为避免在上述过程中析出FeSO4晶体,可采取的措施有__。
(4)制备(NH4)2Fe(SO4)2·6H2O
①向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为___。
②为防止Fe2+被氧化,可采取的主要措施有__(填字母)。
a.(NH4)2SO4固体不配成溶液,直接加入到FeSO4溶液中
b.混合液不蒸发浓缩,直接倒入无水乙醇中析出晶体
c.析出的晶体不用水洗,用90%的乙醇溶液洗涤
d.将实验中所用的乙醇回收,蒸馏后重复使用
(5)产品检验
请补充完整测定产品中SO42-含量的实验方案:准确称取约0.4g样品,溶于70mL水,__,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中须使用的试剂有:2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
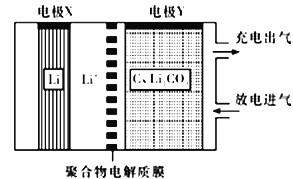
A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有可逆反应.2NO2(g)![]() N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
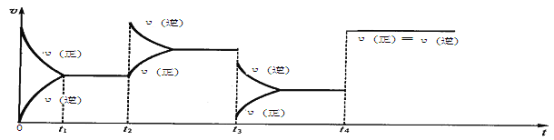
t2:_______________________________________________;
t3:_______________________________________________;
t4:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:________。
(2)“滤渣Ⅰ”的主要成分为__(填化学式),该物质在工业上的用途为_________(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是_________。
(4)“氨解”发生反应的离子方程式为________。“净化”时通入H2S的目的是_______。
(5)“氧化”时发生反应的化学方程式为_________。
(6)“系列操作”具体是指_________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com