
【题目】N2(g)+3H2(g)![]() 2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
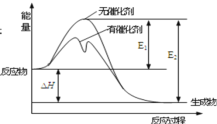
A.该反应正反应的活化能小于逆反应的活化能
B.该反应的逆反应为放热反应
C.使用催化剂使该反应的反应热发生改变
D.该反应的ΔH=E2-E1
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸,且具有还原性。
Ⅰ.20℃时,改变0.1mol·L-1H2C2O4溶液的pH,溶液中的H2C2O4、HC2O4—、C2O42—的物质的量分数δ(X)随pH的变化如图所示。
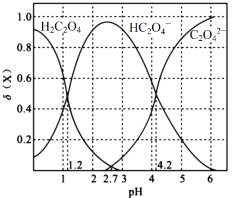
已知
(1)Ka1(H2C2O4)=___________。
(2)0.1mol·L-1NaHC2O4溶液中离子浓度由大到小的顺序是___________。
(3)已知20℃时K(HCOOH)=1.77×10-4,向HCOONa溶液中加入少量H2C2O4,反应的离子方程式是___________。
Ⅱ.KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,因此使用前须用H2C2O4·2H2O配制的标准溶液标定(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)。
(4)准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(5)某学生根据3次实验分别记录有关数据如表所示,该KMnO4溶液的物质的量浓度为___________mol·L-1。
实验序号 | 消耗0.1000mol·L-1的H2C2O4溶液的体积/mL | 待测KMnO4溶液的体积/mL |
1 | 29.90 | 25.00 |
2 | 30.00 | 25.00 |
3 | 30.10 | 25.00 |
(6)在上述滴定过程中,下述操作可导致被测定的KMnO4浓度偏高的是___________
a.未用标准液润洗滴定管
b.达到滴定终点,读数时俯视液面
c.盛装待测液的锥形瓶用蒸馏水洗过,未润洗
d.滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。科学家探究太阳能制氢技术,设计流程图如图:
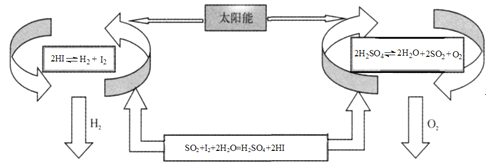
信息提示:以下反应均在150℃发生
2HI(aq)H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4= ______ 。
(2)该制氢气技术的优点是 ______ ,若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ______ 0(填“>”,“<”或“=”)。
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是 ______。
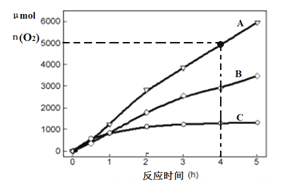
A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250molh-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
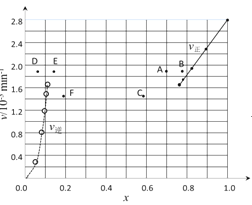
(4)对于反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数 K的计算式为: ______ 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 ______ (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= ______ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 ______ (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。下列有关说法正确的是( )
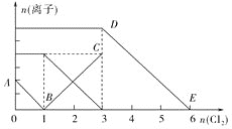
A.线段AB代表Fe2+物质的量的变化情况
B.线段BC代表Fe3+物质的量的变化情况
C.线段DE所发生的离子反应方程式为2Fe2++Cl2===2Fe3++2Cl-
D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
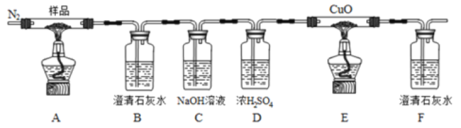
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题:
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为___。
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
①KMnO4脱硫(SO2)的离子方程式为___。
②加入CaCO3的作用是___。
③KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为___。
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:
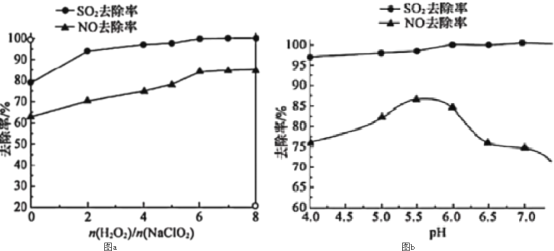
图a和图b中可知脱硫脱硝最佳条件是___。图b中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
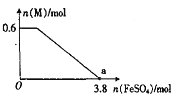
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3mol O2和0.3mol H2OB.![]() 个
个![]() 与0.1mol
与0.1mol ![]()
C.0.1mol ![]() 与0.15mol
与0.15mol ![]() D.0.1mol
D.0.1mol ![]() 与0.1mol
与0.1mol ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com