【答案】
分析:X元素主要化合价为-2,原子半径为0.074nm,则X处于第ⅥA族;
Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,则Z为S元素,X为O元素;
D最高价氧化物既能溶于强酸又能溶于强碱,则D为Al元素;
E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe元素;
Y所在主族序数与所在周期序数之差为4,满足该条件元素为O或Cl,由于X为O元素,则Y为Cl元素.
解答:解:X元素主要化合价为-2,原子半径为0.074nm,则X处于第ⅥA族;Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,则Z为S元素,X为O元素;D最高价氧化物既能溶于强酸又能溶于强碱,则D为Al元素;
E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe元素;Y所在主族序数与所在周期序数之差为4,满足该条件元素为O或Cl,由于X为O元素,则Y为Cl元素.
即X为O元素,Y为Cl元素,Z为S元素,D为Al元素,E为Fe元素.
(1)E为Fe元素,处于元素周期表第四周期第Ⅷ族;Z为S元素,氢化物为H
2S,属于共价化合物,硫原子与氢原子之间形成1对共用电子对,电子式为
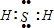
.
故答案为:第四周期第Ⅷ族;

.
(2)X为O元素,其氢化物为H
2O,常温为液态,氧元素电负性很强,水分子之间存在氢键,所以沸点硒化氢<H
2O.
故答案为:<.
X、Y、D形成的简单离子分别为O
2-、Cl
-、Al
3+.O
2-、Al
3+离子的核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径O
2->Al
3+,Cl
-、O
2-的最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl
->O
2-,所以离子半径Cl
->O
2->Al
3+.
故答案为:<;Cl
->O
2->Al
3+.
(3)X为O元素,X的一种氢化物可用于实验室制取X的单质,则为过氧化氢分解制取氧气,反应方程式为
2H
2O
2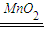
2H
2O+O
2↑;D的最高价氧化物为Al
2O
3,溶于强碱生成偏铝酸根离子和水,
离子方程式为Al
2O
3+2OH
-=2AlO
2-+H
2O.
故答案为:2H
2O
2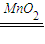
2H
2O+O
2↑;Al
2O
3+2OH
-=2AlO
2-+H
2O.
(4)E元素与Y元素可形成EY
2和 EY
3两种化合物为FeCl
2、FeCl
3.
①FeCl
2易被氧气氧化,保存FeCl
2溶液时,需向溶液加入少量Fe单质,故①正确;
②FeCl
2可通过FeCl
3与Fe化合得到,FeCl
3可由铁与氯气化合得到,故②正确;
③铜片、碳棒和FeCl
3溶液组成原电池,铜发生氧化反应,为负极,电子由铜片沿导线流向碳棒,故③正确;
④向煮沸的NaoH溶液中滴加几滴饱和FeCl
3溶液,得到氢氧化铁沉淀,不能得到氢氧化铁胶体,故④错误.
故选:①②③.
(5)甲为上述五种元素中的两种组成,乙在常温下为液态,则乙为水,工业上常用电解戊冶炼金属,戊为氧化铝,所以丁为氢氧化铝,故甲为铝盐,故为氯化铝.则甲与乙发生反应的化学方程式 AlCl
3+3H
2O
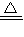
Al(OH)
3+3HCl↑.
故答案为:AlCl
3+3H
2O

Al(OH)
3+3HCl↑.
点评:以元素推断为载体,考查化学用语、半径比较、元素化合物性质等,综合性较大,难度中等,是对所学知识的综合性考查,注意基础知识的理解掌握.推断元素是解题关键.


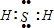 .
. .
.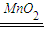 2H2O+O2↑;D的最高价氧化物为Al2O3,溶于强碱生成偏铝酸根离子和水,
2H2O+O2↑;D的最高价氧化物为Al2O3,溶于强碱生成偏铝酸根离子和水,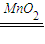 2H2O+O2↑;Al2O3+2OH-=2AlO2-+H2O.
2H2O+O2↑;Al2O3+2OH-=2AlO2-+H2O. Al(OH)3+3HCl↑.
Al(OH)3+3HCl↑. Al(OH)3+3HCl↑.
Al(OH)3+3HCl↑.




 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下
